北理工課題組在靶向sEH酶的抗炎天然藥物全合成開發(fā)研究中取得重要進展
發(fā)布日期:2024-12-11 供稿:化學(xué)與化工學(xué)院 攝影:化學(xué)與化工學(xué)院
編輯:田柳 審核:王振華 閱讀次數(shù):
近日,北京理工大學(xué)化學(xué)與化工學(xué)院梁建華教授課題組在靶向sEH的抗炎天然藥物開發(fā)領(lǐng)域取得重要進展,,相關(guān)成果發(fā)表在藥物化學(xué)國際頂級期刊Journal of Medicinal Chemistry ,??扇苄原h(huán)氧化物水解酶(sEH)是一個很有前途的炎癥治療靶點,,但天然產(chǎn)物骨架在這方面并未得到應(yīng)有的重視和深入研究,,這導(dǎo)致了目前的化合物存在藥物吸收差代謝快、血液濃度低等缺陷,。我們的研究通過二苯乙烯的戰(zhàn)略性骨架躍遷,在雙側(cè)或者單側(cè)進行了構(gòu)象限制的環(huán)合重新設(shè)計了天然產(chǎn)物小檗堿和血根堿,,實現(xiàn)了全合成制備氨基小檗堿等目標化合物,,創(chuàng)造出具有強效體內(nèi)療效的新型sEH抑制劑。北京理工大學(xué)梁建華教授,、于明加預(yù)聘助理教授,,琶洲實驗室朱心紅教授和北京化工大學(xué)馮越教授為本文共同通訊作者,北京理工大學(xué)為第一通訊單位,。
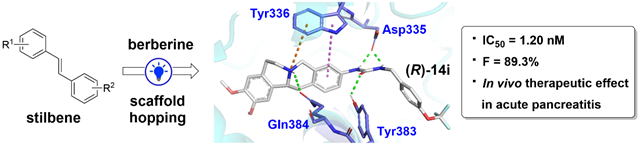
圖1 從二苯乙烯優(yōu)化得到化合物( R )-14i
急性胰腺炎作為胃腸道患者住院的常見病因,,大約25%的患者病情會發(fā)展為死亡率高達30%的重癥急性胰腺炎,然而卻尚無有效的特異性治療藥物,。sEH酶能夠水解體內(nèi)的抗炎因子環(huán)氧脂肪酸EETs,,因而研究人員開發(fā)了一系列sEH抑制劑試圖治療急性胰腺炎在內(nèi)的諸多炎癥性疾病,。不幸的是現(xiàn)有的sEH抑制劑普遍存在低溶解度、藥代動力學(xué)性質(zhì)較差的問題,,在一定程度上影響了急性胰腺炎療效,。基于此問題,,我們以二苯乙烯WS-82(IC50 = 644 nM)為先導(dǎo)化合物,,結(jié)合抗炎活性優(yōu)良的生物堿類化合物結(jié)構(gòu),通過骨架躍遷的理念設(shè)計并通過全合成得到了一系列新型小檗堿,、血根堿衍生物,,首先實現(xiàn)了氨基小檗堿的簡便全合成路線,隨后進行了關(guān)于sEH抑制活性的構(gòu)效關(guān)系研究,。在表現(xiàn)出優(yōu)良體外抑制活性的化合物中,,外消旋體14i和28i在抑制小鼠軟組織炎癥模型方面表現(xiàn)出了優(yōu)于陽性對照TPPU的療效。14i經(jīng)手性拆分后,,通過CD譜圖及ECD計算確認構(gòu)型得到的( R )-14i(LXZ-42,,IC50 = 1.20 nM)表現(xiàn)出高效體外抑制活性、微弱細胞毒性,、高效體內(nèi)軟組織炎癥抑制活性,,因而被認定為優(yōu)選化合物進行了深入研究。
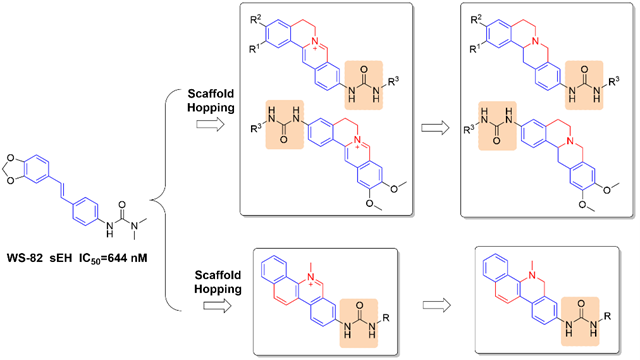
圖2 骨架躍遷設(shè)計新型小檗堿,、血根堿衍生物
研究表明,,( R )-14i在體內(nèi)急毒實驗中表現(xiàn)出了低肝毒性和腎毒性,有著良好的生物安全性,;在藥代動力學(xué)實驗中口服生物利用度高達89%,,超過了絕大多數(shù)報道的sEH抑制劑。此外,,( R )-14i能夠明顯逆轉(zhuǎn)急性胰腺炎小鼠模型的組織病理學(xué)損傷程度,,同時顯著抑制小鼠體內(nèi)sEH酶活性,提升EETs/DHETs比例從而發(fā)揮治療急性胰腺炎作用,。( R )-14i與sEH蛋白的共晶結(jié)構(gòu)表明( R )-14i可以進入sEH的L形空腔,,通過氫鍵等強相互作用力與蛋白牢固結(jié)合。這些發(fā)現(xiàn)為sEH抑制劑進一步的臨床開發(fā)提出了新的骨架,,突出了( R )-14i作為治療急性胰腺炎的有前途的候選藥物的潛力,。
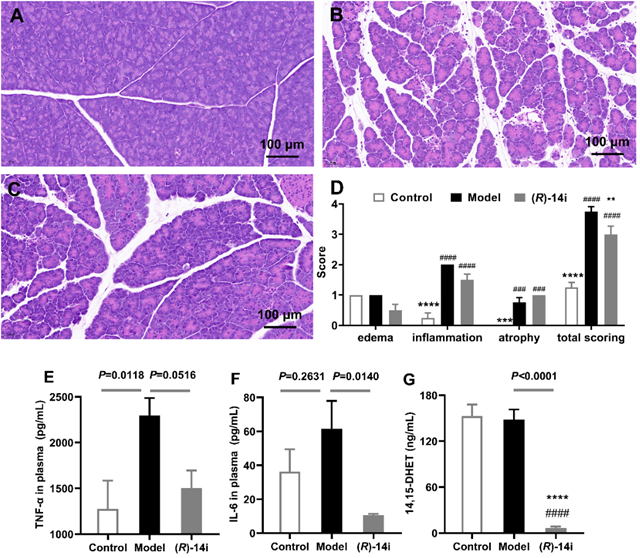
圖3 化合物( R )-14i在急性胰腺炎小鼠模型中的治療效果
附作者簡介:
第一作者:北京理工大學(xué)化學(xué)與化工學(xué)院碩士研究生劉興周、謝維松以及博士研究生丁靜,,北京化工大學(xué)都曉瑜,。
通訊作者:梁建華,北京理工大學(xué)教授,,醫(yī)藥分子科學(xué)與制劑工程工信部重點實驗室副主任,,研究方向為重大疾病相關(guān)的新藥創(chuàng)制,;朱心紅,國家杰青,,琶洲實驗室腦疾病與健康研究中心主任,,研究方向為精神疾病發(fā)病機制和干預(yù);馮越,,北京化工大學(xué)教授,,研究方向為藥物作用機制;于明加,,北京理工大學(xué)化學(xué)與化工學(xué)院預(yù)聘助理教授,,研究方向為藥物的智能設(shè)計。
本研究受到科技創(chuàng)新2030-腦科學(xué)與類腦研究重大項目,、國家自然科學(xué)基金面上項目資助,。
分享到:
