北理工課題組在新型可電離脂質核酸載體及降血脂藥物研究方面取得進展
發(fā)布日期:2022-03-17 供稿:前沿交叉科學研究院
編輯:石殊倫 審核:唐水源 閱讀次數:
近日,北京理工大學前沿交叉科學研究院黃淵余課題組在新型可電離脂質的核酸遞送載體以及降血脂siRNA藥物研究方面取得重要研究進展。該成果以《Thermostable ionizable lipid-like nanoparticle (iLAND) for RNAi treatment of hyperlipidemia》為題發(fā)表于《Science Advances》(IF= 14.136)。該論文第一作者為北京理工大學生命學院/前沿交叉科學研究院博士研究生胡泊,通訊作者為黃淵余教授。前沿交叉院李博副研究員、梁興杰兼職教授等亦參與了研究和討論。
核酸生物醫(yī)藥,包括小干擾核酸(siRNA)、信使核酸(mRNA)、反義核酸(ASO)、基因編輯系統(tǒng)(CRISPR/Cas)等,是人類未來制藥技術的代表性方向。基于mRNA的新型核酸疫苗(Moderna的mRNA-1273、BioNTech/輝瑞的BNT162b2)在全球新冠疫情防控中發(fā)揮了重要作用。同時,與傳統(tǒng)小分子藥物、抗體蛋白藥物相比,siRNA藥物具有靶點范圍更廣、藥效時間更長、開發(fā)周期更短、成功率更高等突出優(yōu)勢。但缺乏安全高效、生產可控、自主知識產權的體內遞送系統(tǒng),是上述核酸藥物或疫苗研發(fā)所面臨的關鍵“卡脖子”難題。可電離脂質納米顆粒(ionizable lipid nanoparticle, iLNP)是最具前景、應用最成熟、競爭最激烈的遞送載體類型。
近幾年,黃淵余團隊構建了一個新型可電離脂質分子庫,從中選擇了不同結構的親水頭和不同基團的疏水尾,組合并合成了其中4種可電離脂質作為研究代表。研究人員利用正交試驗設計(DOE)將含有可電離脂質、磷脂、膽固醇、聚乙二醇脂質的候選配方從1024個降至64個,表征其理化性質,并在細胞水平進行了活性篩選。結果顯示,這些候選配方均實現了siRNA的高效負載,且大部分實現了對靶標mRNA的高效抑制。最后,研究人員將最優(yōu)選的脂質納米體系命名為iLAND(ionizable lipid assisted nucleic acid delivery system/可電離脂質輔助的核酸遞送系統(tǒng),也稱為intelligent LANDing technology/智能“著陸”技術)。
接著,研究人員用iLAND負載靶向ApoB基因的siRNA。在小鼠體內單次注射0.01-3 mg/kg該制劑后,檢測到iLAND介導的半數有效劑量(ED50)低至0.18 mg/kg,單次給藥后4周仍可實現約50%的基因抑制。此外,所有接受測試的動物均耐受良好,血清生化以及病理學分析結果也證明iLAND具有良好的體內安全性。
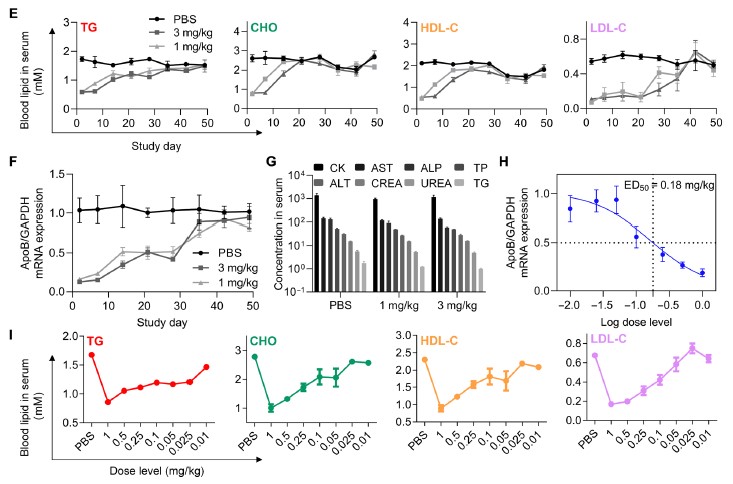
圖1 siRNA@iLAND的遞送效率以及安全性評估
進一步,研究人員分別以飼料誘導的高脂血小鼠、db/db轉基因小鼠以及人源化載脂蛋白C3(ApoC3)轉基因小鼠作為疾病動物模型,模擬了人類由不健康飲食引起的高脂血癥以及單基因表達異常誘發(fā)的高脂血癥。實驗結果證明,在經過重復給藥后,0.25mg/kg的siRNA制劑在三種模型中均將疾病動物的血脂水平調整至與正常動物相當的水平。此外,0.5mg/kg的siRNA在db/db小鼠體內實現了97%的靶標mRNA表達下調。在轉基因動物中,血脂水平在停藥后4周后回復到治療前。總的來說,由iLAND遞送的siRNA極為高效地抑制了靶標mRNA的表達,進而帶來了十分積極的降血脂治療效果。
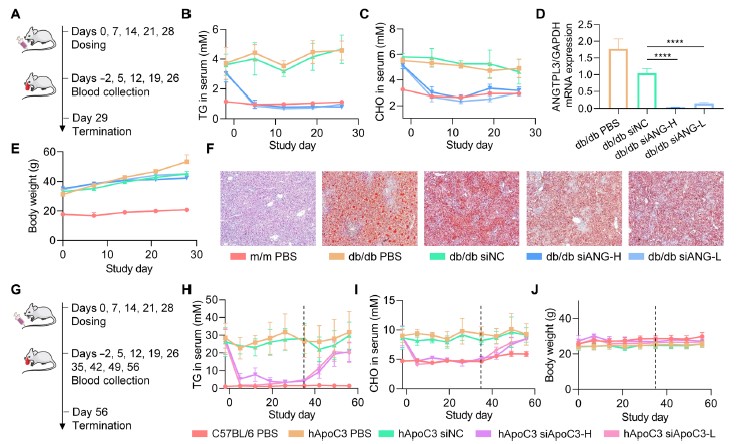
圖2 在小鼠疾病模型上進行的藥效試驗。
iLAND體系除了具備遞送效率高、安全性好、療效佳的優(yōu)點外,還顯示了良好的化學結構穩(wěn)定性和制劑穩(wěn)定性,具備優(yōu)良的藥物開發(fā)潛力。進一步,iLAND還擁有理想的體內遞送mRNA的效果(數據未發(fā)表)。上述研究成果已提交PCT專利申請。
論文鏈接: https://www.science.org/doi/10.1126/sciadv.abm1418
附作者簡介:
黃淵余,北京理工大學教授、課題組長、博士生導師;國家級青年人才獲得者、北京市科技新星。研究興趣主要圍繞核酸技術與藥物/疫苗展開。以通訊/第一作者在Sci Adv、Signal Transduct Target Ther、Nano Lett等發(fā)表論文50余篇,IF>10論文20余篇;共發(fā)表論文約80篇,撰寫10余部專著章節(jié),申請14件專利。曾獲得中美納米醫(yī)學與納米生物技術學會“未來之星”獎(2019)等榮譽;是中國生物物理學會納米生物學分會秘書長,另多個學會理事或委員;是Exploration副主編(Wiley出版)、Chinese Chemical Letters、生物化學與生物物理進展等多個期刊(青年)編委。
教師主頁: https://www.x-mol.com/groups/Yuanyu_Huang-BIT
分享到:
