北理工課題組在一種中性單分子載體遞送磷/膦酸鹽藥的研究中取得新進展
發(fā)布日期:2025-05-26 供稿:化學與化工學院 攝影:化學與化工學院
編輯:田柳 審核:王振華 閱讀次數(shù):
近日,北京理工大學化學與化工學院吳彪教授、唐娟特別研究員和趙偉特別研究員在國際知名化學期刊《Angewandte Chemie International Edition》上發(fā)表題目為“A Neutral Single-Molecule Carrier for Delivery of Phosphonate Drugs”的研究論文。該論文的第一作者為北京理工大學博士研究生聶清玲。此項研究得到了國家自然科學基金,北京市自然科學基金和北京理工大學青年教師學術(shù)啟動計劃等項目的資助及北京理工大學分析測試中心的支持。
磷/膦酸基團是抗病毒、抗腫瘤及抗骨質(zhì)疏松藥物的關(guān)鍵活性基團,然而其高親水性和多重負電荷特性嚴重阻礙該類藥物的跨膜轉(zhuǎn)運,導致生物利用度低(例如,臨床使用的雙膦酸鹽的生物利用度僅為1%)。為提高磷/膦酸鹽藥物(PDs)療效并減少其副作用,現(xiàn)有策略包括:(1)小分子酯化修飾,以增強親脂性,但需要對藥物分子逐一進行修飾;(2)納米顆粒載體,雖具廣泛的藥物適應(yīng)性,卻存在載藥量批次間差異大的問題而導致臨床應(yīng)用受限制。針對上述科學問題,亟待開發(fā)可通過明確結(jié)構(gòu)實現(xiàn)明確的藥物負載且具有廣譜藥物適應(yīng)性的載體。單分子載體憑借分子級精準封裝能力成為新興解決方案。然而,具有水合能高、幾何形狀復雜的磷/膦酸藥物與載體間有效結(jié)合是極具挑戰(zhàn)性的。目前的研究僅有兩例陽離子型環(huán)糊精衍生物作為分子載體通過靜電作用結(jié)合三磷酸鹽實現(xiàn)細胞水平的遞送( Sci. Rep. 2017, 7, 8353.; Angew. Chem. Int. Ed. 2018, 57, 9891-9895.)。
團隊前期開發(fā)的三足六脲配體( Chem. Sci . 2019, 10, 2483-2488; Chem. Commun . 2023, 59, 12923-12926.; Angew. Chem. Int. Ed . 2024, 63, e202403314.)通過12個預組織氫鍵結(jié)合磷酸鹽物種,其常數(shù)( K a)高達 106 M?1。為了通過“籠效應(yīng)”進一步提高結(jié)合親和力,本研究設(shè)計了一種由兩個六脲單元通過剛性苯基連接的中性籠狀結(jié)構(gòu)(cage 1)。該載體通過預組織的多重氫鍵與多種PDs(包括單磷酸鹽、雙膦酸鹽及三磷酸鹽)形成強效結(jié)合,并利用動態(tài)氫鍵特性實現(xiàn)水性環(huán)境中的可控釋放(圖1A)。晶體結(jié)構(gòu)與功能驗證表明,cage 1可自適應(yīng)調(diào)整腔體構(gòu)象以適配不同尺寸藥物分子,進一步通過大胞飲內(nèi)吞途徑將藥物高效遞送至溶酶體,為克服傳統(tǒng)遞送難題提供了創(chuàng)新思路。
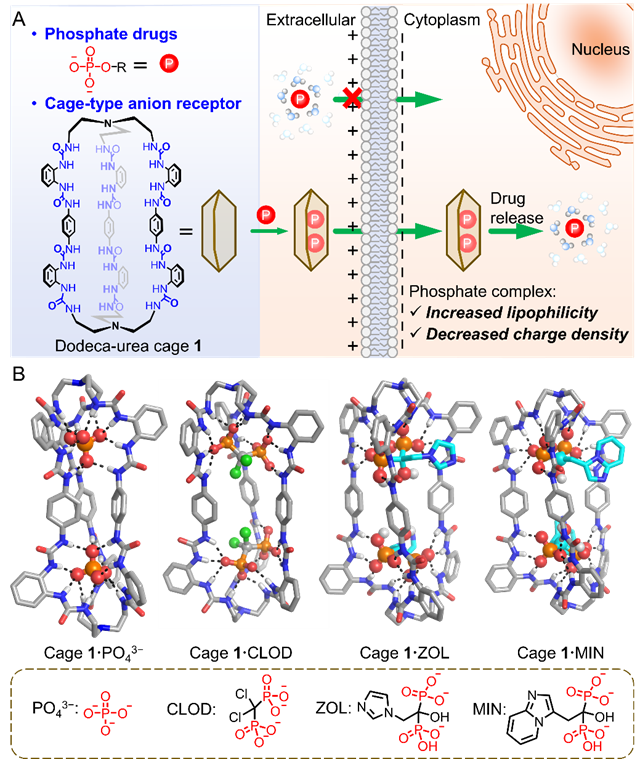
圖1 cage1跨膜轉(zhuǎn)運磷/膦酸鹽藥物示意圖
以硫酸根離子為模板,三足三脲前體與1,4-亞苯基二異氰酸酯通過一鍋法反應(yīng)合成十二脲分子籠(cage 1)。單晶分析表明,cage 1與不同PDs以1:2結(jié)合(圖1B),每個陰離子通過多重氫鍵穩(wěn)定結(jié)合于六脲單元內(nèi)。籠狀結(jié)構(gòu)的軸向高度及中間苯環(huán)形成的空腔可動態(tài)調(diào)整以適配不同尺寸陰離子。核磁共振(NMR)滴定分析顯示(圖2A),連續(xù)滴定PDs導致cage 1的NH質(zhì)子產(chǎn)生顯著低場位移,伴隨復合物特征峰的出現(xiàn),證明PDs與cage 1在NMR時間尺度下存在慢交換熱力學結(jié)合機制。溶劑極性效應(yīng)實驗證實,水含量的梯度增加(從0.5%增加至20%(H2O/DMSO- d 6))顯著削弱配合物主客體間的氫鍵相互作用(圖2B),導致cage 1與PDs的結(jié)合常數(shù)呈現(xiàn)數(shù)量級遞減:從106 M?1降至104 M?1。由此推演,純水溶液中cage 1與PDs的結(jié)合常數(shù)將顯著降低(<<10<>4 M?1),再次驗證cage 1在水環(huán)境中能夠高效釋放PDs。等溫滴定量熱法(ITC)測得的復合物1?PD的結(jié)合常數(shù) K a1為106~ 107 M?1(圖2C),與磷酸鹽轉(zhuǎn)運蛋白( K a = 106 M?1)相當,且不同PD底物間的結(jié)合常數(shù)差異極小,同樣表明cage 1具有自適應(yīng)陰離子結(jié)合特性。
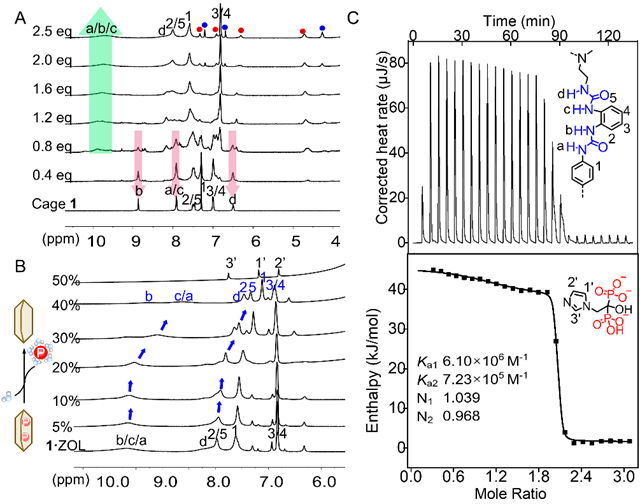
圖2 cage1與PD的結(jié)合
為評估cage 1對PDs的遞送效果,本研究首先測試了cage 1對多種腫瘤細胞(如HeLa、HepG2、MDA-MB-231、PC-3和 4T1)的細胞毒性,即使在100 μM條件下,細胞存活率仍顯著高于安全閾值,凸顯其優(yōu)異的生物相容性。本研究首先采用熒光標記的單磷酸鹽、雙膦酸鹽(BPs)及三磷酸鹽作為模型藥物,通過共聚焦顯微鏡直觀展示了復合物的胞內(nèi)積累效果。結(jié)果顯示,cage 1?PDs復合物處理的細胞其熒光強度較游離藥物組顯著增強了33~45倍(圖3A, 3B),文獻中帶正電荷的環(huán)糊精遞送的PD在MCF7細胞中的熒光強度只提高了5倍。抗腫瘤細胞增殖實驗進一步證明,相比起游離的雙膦酸鹽,cage 1遞送的雙膦酸鹽對腫瘤細胞對腫瘤細胞的增殖抑制效率提升2-4倍(圖3C, 3D),且該效果在多種細胞系中均保持一致(圖3E)。相較于與原藥酯化(提高1.3倍)或非靶向單功能雙膦酸鹽納米載體(效果忽略不計),cage 1展現(xiàn)更優(yōu)越的遞送效率。cage 1通過精準PD藥物負載與可控釋放,為改善磷/膦酸鹽類藥物的臨床療效提供了可靠依據(jù)。
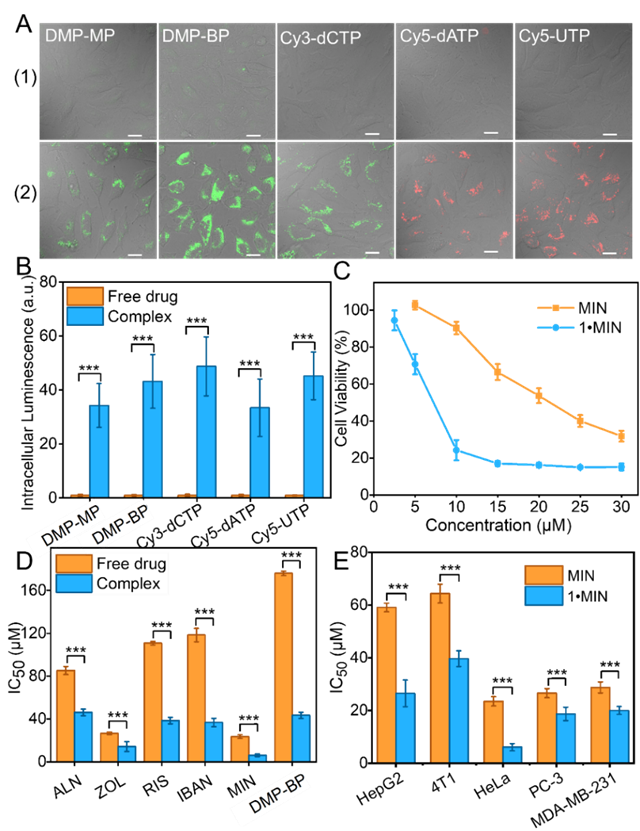
圖3. cage1在活細胞中遞PDs的實驗
本研究進一步探究了蛋白對cage 1遞送PD的作用。首先,共聚焦成像(CLSM)分析顯示,復合物的細胞攝取高度依賴血清蛋白(圖4A, 4B):在含胎牛血清(FBS)或BSA的培養(yǎng)基中,胞內(nèi)熒光強度顯著提升,而無蛋白條件下PDs的內(nèi)化效率顯著降低,表明蛋白冠通過疏水屏蔽作用維持PDs與cage 1的結(jié)合穩(wěn)定性。動態(tài)光散射(DLS)研究表明,cage 1?PD復合物在含血清環(huán)境中形成~200 nm納米聚集體(適配大胞飲途徑);而無血清條件下因缺乏蛋白冠保護導致聚集體尺寸增至~4.2 μm。熒光共振能量轉(zhuǎn)移(FRET)分析進一步證實cage 1可介導血清白蛋白(BSA)與PDs形成穩(wěn)定三元復合物,而游離PDs無此結(jié)合特性。最后,本研究深入探究了配合物的細胞內(nèi)化機制。通過配合物內(nèi)吞抑制實驗結(jié)合透射電鏡(TEM)(圖4C)觀察到的特征性細胞膜內(nèi)陷及直徑>500 nm的囊泡結(jié)構(gòu),確認大胞飲作用為其主要攝取途徑。PDs與溶酶體共定位實驗進一步揭示配合物經(jīng)大胞飲內(nèi)吞后靶向溶酶體/內(nèi)體區(qū)室(圖4D),PDs的釋放過程與蛋白質(zhì)冠解離及溶酶體酸化微環(huán)境存在協(xié)同作用(圖4E)。體內(nèi)分布實驗證實cage 1?PD配合物通過增強滲透與滯留(EPR)效應(yīng)實現(xiàn)腫瘤組織特異性積累,其腫瘤區(qū)域熒光強度較游離藥物提升(圖4F)。這種具有腫瘤選擇性的遞送方式可實現(xiàn)磷/膦酸鹽類治療藥物(包括核苷酸類似物和寡聚核酸藥物)的精確靶向,從而有效抑制腫瘤和進行聯(lián)合治療,推動精準腫瘤學的前沿發(fā)展。
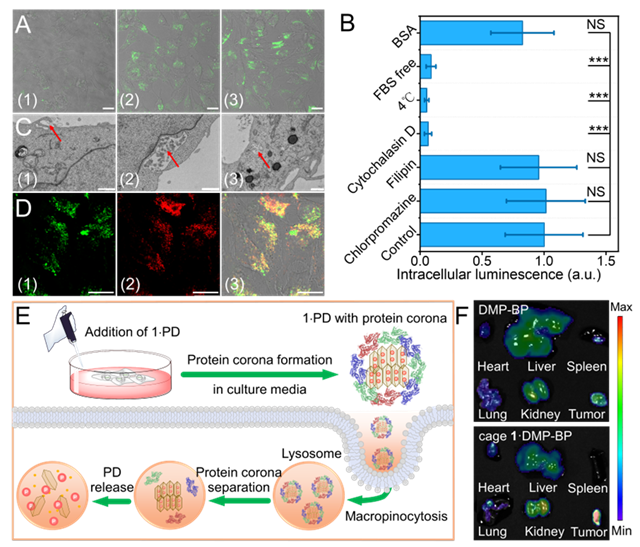
圖4 探索細胞攝取PD復合物的途徑
綜上所述,我們開發(fā)了一種中性陰離子受體(cage 1)作為單分子載體,基于陰離子配位策略成功解決了PDs的遞送難題。cage 1與PD的結(jié)合親和力達106~107 M?1,與天然磷酸鹽轉(zhuǎn)運蛋白相當。cage 1遞送的PDs通過大胞飲內(nèi)吞途徑進入細胞,并將藥物輸送到溶酶體,使細胞內(nèi)的藥物富集量增加33-45倍,并使PDs對腫瘤細胞的增殖抑制效果提高2-4倍。體內(nèi)實驗證實其可通過增強滲透與滯留(Enhanced Permeability and Retention effect,EPR)效應(yīng)實現(xiàn)配合物在腫瘤部位選擇性富集。該遞送策略具有以下主要優(yōu)勢:(a)分子級封裝,可精確裝載藥物;(b)cage 1使PDs親水性和負電荷密度降低,易于穿透細胞;以及(c)主客體通過動態(tài)氫鍵結(jié)合,藥物釋放可控。該研究為設(shè)計電中性的單分子載體遞送磷酸鹽藥物提供了新的思考方向。
原文鏈接: https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202509002
附通訊作者簡介:
吳彪,北京理工大學化學與化工學院教授,博導,國家級領(lǐng)軍人才。現(xiàn)任醫(yī)藥分子科學與制劑工程工信部重點實驗室主任。原創(chuàng)性地發(fā)展了“陰離子配位超分子組裝化學”研究方向,在JACS,ACIE等國際知名高水平期刊發(fā)表學術(shù)論文200余篇,科研成果獲省部級科學技術(shù)一等獎。研究方向為通過設(shè)計和合成陰離子配體、研究其配位性質(zhì),發(fā)展和完善陰離子配位化學理論,指導高級有序組裝結(jié)構(gòu)的精準構(gòu)筑和功能控制。
唐娟,特別研究員,博導。2020年12月加入北京理工大學化學與化工學院,研究方向主要集中在化學與生命科學的交叉領(lǐng)域,旨在通過發(fā)展化學工具探測和調(diào)節(jié)生命過程,揭示生物事件的發(fā)生發(fā)展規(guī)律,為疾病的治療提供新思路。包括:1)發(fā)展低能量光可活化熒光探針監(jiān)測細胞通訊動力學;2)發(fā)展陰離子配體靶向性治療癌癥;3)發(fā)展不含重金屬的光敏劑用于癌癥的光動力治療。主持國家自然科學基金青年項目,北理工青年教師學術(shù)啟動計劃和北京理工大學科技創(chuàng)新計劃科研基地科技支撐專項計劃。在國內(nèi)外學術(shù)刊物上發(fā)表學術(shù)論文30余篇,包括 J. Am. Chem. Soc., Angew. Chem. Int. Ed., Chem. Sci. 等。
趙偉,特別研究員,博導。2020年7月加入北京理工大學化學與化工學院,從事陰離子配位作用相關(guān)的超分子化學研究,包括配體分子的理性設(shè)計、結(jié)構(gòu)調(diào)控及其在離子分離純化等領(lǐng)域的應(yīng)用。主持國家自然科學基金、北京市自然科學基金和北理工青年教師學術(shù)啟動計劃。近年來,授權(quán)國家發(fā)明專利2項,在國內(nèi)外學術(shù)刊物上發(fā)表學術(shù)論文40余篇,包括 Science, Chem, J. Am. Chem. Soc., Angew. Chem. Int. Ed., CCS Chemistry 等。
分享到:
