北理工課題組研究揭示SMURF1通過促進受損溶酶體自噬降解維持細胞穩(wěn)態(tài)
發(fā)布日期:2024-10-11 供稿:生命學院 攝影:生命學院
編輯:肖雯 審核:常非 閱讀次數(shù):
近日,北京理工大學生命學院董磊教授課題組在自噬領域頂級期刊《Autophagy》最新發(fā)表題為“SMURF1 mediates damaged lysosomal homeostasis by ubiquitinating PPP3CB to promote the activation of TFEB”的研究論文。
巨自噬/自噬是通過形成自噬體和自噬溶酶體(成熟自噬體與溶酶體融合形成)來降解細胞內(nèi)受損的細胞器和/或錯誤折疊蛋白的重要的細胞循環(huán)過程,并參與各種生理和病理過程。自噬轉錄因子TFEB通過與溶酶體表達和調(diào)控(CLEAR)基序的靶基因結合,也在溶酶體穩(wěn)態(tài)中發(fā)揮關鍵作用。先前的研究發(fā)現(xiàn)MTORC1(MTOR復合物1)、RRAG、TRIM16、LC3脂質(zhì)化和 SMURF1在不同條件下參與TFEB的核轉運。一般來說,TFEB(S211)可以被在溶酶體表面的MTORC1激酶磷酸化,然后與YWHA(酪氨酸3-單氧酶/色氨酸5-單氧酶激活蛋白)/14-3-3結合,導致其在細胞質(zhì)中滯留。且溶酶體受損會通過以ATG依賴的方式選擇性地損害 MTORC1介導的TFEB S211磷酸化減少,降低與YWHA/14-3-3的結合。另外,PPP3/calcineurin 是唯一受細胞內(nèi)鈣調(diào)控的絲氨酸/蘇氨酸蛋白磷酸酶。活化的PPP3/calcineurin會使細胞質(zhì)中的TFEB去磷酸化,會導致其核轉位并激活自噬相關基因。然而,在溶酶體損傷情況下如何調(diào)節(jié)TFEB激活的聯(lián)動分子機制仍尚未清楚。
北京理工大學生命學院董磊教授團隊前期發(fā)現(xiàn)阻斷SMURF1(SMAD特異性E3泛素蛋白連接酶通過抑制TFEB的核轉運,從而阻礙對溶酶體損傷的自噬生成。半乳糖凝集素(galectins)識別內(nèi)膜溶酶體的損傷信號,導致SMURF1和PPP3/calcineurin被招募到溶酶體上,形成了LGALS3- SMURF1-PPP3/calcineurin復合體,該復合體能夠穩(wěn)定TFEB,從而去磷酸激活TFEB并進行溶酶體生成相關基因的表達。SMURF1作為一個連接環(huán)境壓力和自噬/自溶酶體聯(lián)動的核心蛋白,參與調(diào)控了TFEB的激活。
該課題組最新發(fā)表的研究論文進一步闡釋了鈣離子依賴磷酸酶PPP3/calcineurin在溶酶體穩(wěn)態(tài)調(diào)控中復合物形成中的“橋梁”作用與SMURF1的協(xié)同機制。首先,PPP3CB作為橋梁,在溶酶體損傷后通過與LGALS3結合,招募SMURF1,形成LGALS3- SMURF1-PPP3/calcineurin復合體。其中,PPP3CB通過去磷酸化LGALS3的方式促進LGALS3開放構象的形成,增加NT(N端尾部結構域)和CRD(C端碳水化合物識別域)之間的解離。此外,SMURF1能夠泛素化修飾PPP3CB(蛋白磷酸酶3催化亞基β)促進受損溶酶體的自噬降解。在受到細胞內(nèi)的鈣信號刺激時,PPP3CB的第146位賴氨酸處被招募的SMURF1泛素化。SMURF1對PPP3CB的K63泛素化增強了對TFEB的招募。另一方面,活化的PPP3CB和調(diào)節(jié)亞基PPP3R1直接與TFEB相互作用,促進TFEB的構象校正,進而激活TFEB靶向基因的轉錄(圖1)。
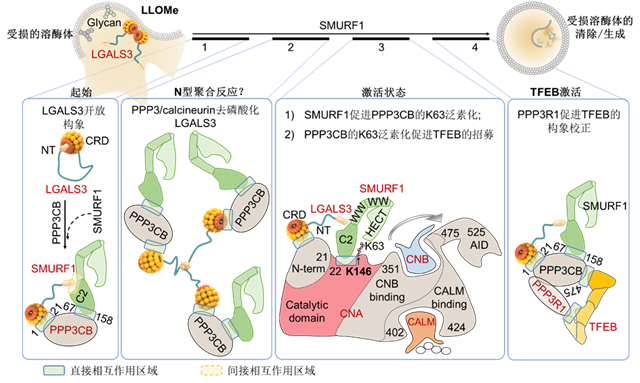
圖1 SMURF1參與溶酶體損傷后受損溶酶體清除過程的示意圖(圖源自于Autophagy)
這項研究揭示了PPP3CB及其泛素連接酶SMURF1對溶酶體損傷的細胞應激響應的關鍵機制,解析TFEB在溶酶體損傷情況下亞細胞定位的通路的分子機制在未來有利于SMURF1作為治療應激相關疾病的潛在藥物靶點的可行性。
原文鏈接:https://www.tandfonline.com/doi/full/10.1080/15548627.2024.2407709
分享到:
