北理工前沿交叉院黃淵余課題組在Mol Ther Nucleic Acids上相繼發(fā)表胰腺癌治療研究論文和ESI高被引綜述論文
發(fā)布日期:2018-08-20 供稿:前沿交叉科學(xué)研究院
編輯:朱倩云 審核:王博 閱讀次數(shù):
北京理工大學(xué)前沿交叉科學(xué)研究院黃淵余特別副研究員課題組長(zhǎng)期從事核酸技術(shù)與藥物的相關(guān)研究,近日在核酸研究與醫(yī)學(xué)領(lǐng)域重要期刊《分子治療-核酸》(Molecular Therapy-Nucleic Acids,IF="5.66)在線發(fā)表抗胰腺癌小干擾核酸藥物方向的最新研究成果。另外,課題組于2017年3月在該期刊發(fā)表的另外一篇綜述論文,時(shí)隔一年已入選Web" of Science數(shù)據(jù)庫(kù)ESI高被引論文。
1.抗胰腺癌小干擾核酸藥物的研究
近期,黃淵余課題組在小干擾RNA治療胰腺癌領(lǐng)域取得重要研究進(jìn)展,相關(guān)成果以“siRNA Knockdown of RRM2 Effectively Suppressed Pancreatic Tumor Growth Alone or Synergistically with Doxorubicin”為題,于2018年8月8日在Molecular Therapy-Nucleic Acids,(IF="5.66)在線發(fā)表。文中針對(duì)胰腺癌治療靶點(diǎn)設(shè)計(jì)篩選了可精準(zhǔn)干預(yù)基因表達(dá)的小核酸藥物,并在體外細(xì)胞模型、體內(nèi)動(dòng)物模型探究了該藥物單獨(dú)使用、或與化療藥物阿霉素聯(lián)合使用治療胰腺癌的效果及機(jī)制,為該疾病治療提供了潛在的新思路和方案。
胰腺癌是一種惡性程度很高、診斷和治療都很困難的惡性腫瘤,其發(fā)病率和死亡率近年來明顯上升,5年生存率小于1%,是預(yù)后最差的惡性腫瘤之一。研究表明,核糖核苷酸還原酶(Ribonucleotide reductase, RR)是細(xì)胞進(jìn)行DNA合成和復(fù)制過程中的限速酶,在腫瘤細(xì)胞分裂、疾病發(fā)生發(fā)展過程扮演了十分重要的角色,其RRM2亞型在許多腫瘤細(xì)胞高表達(dá),是一種新的腫瘤治療靶基因和腫瘤標(biāo)志物。
該研究首先針對(duì)靶基因RRM2設(shè)計(jì)了23條小干擾RNA(siRNA)藥物分子,通過高通量活性評(píng)價(jià)技術(shù)篩選出高活性的優(yōu)選siRNA分子,進(jìn)而通過精確的化學(xué)修飾策略對(duì)藥物分子進(jìn)行修飾,最終得到高活性、特異性及穩(wěn)定性的先導(dǎo)分子siRRM2。進(jìn)一步,該研究以人胰腺癌細(xì)胞系PANC1為模型,在體外細(xì)胞水平、以及體內(nèi)荷瘤小鼠模型上開展研究,結(jié)果顯示,該先導(dǎo)分子單獨(dú)使用、或與臨床一線癌癥化療藥物阿霉素(DOX)聯(lián)合使用,均可有效將細(xì)胞分裂周期阻滯在S期,進(jìn)而抑制腫瘤細(xì)胞生長(zhǎng)、細(xì)胞集落形成,降低細(xì)胞活力,并在體內(nèi)顯著抑制腫瘤組織的生長(zhǎng)。同時(shí),該研究揭示siRRM2與DOX聯(lián)合使用的治療效果顯著優(yōu)于各自單獨(dú)使用,體現(xiàn)出了不同作用機(jī)制藥物之間良好的協(xié)同效應(yīng)。總之,該研究不僅為胰腺癌治療驗(yàn)證了潛在新靶點(diǎn)(RRM2)、獲得了高效安全的新藥物分子,更為疾病防控建立了siRNA單用、或與化療藥聯(lián)用的治療新策略,具有一定的臨床轉(zhuǎn)化潛力。
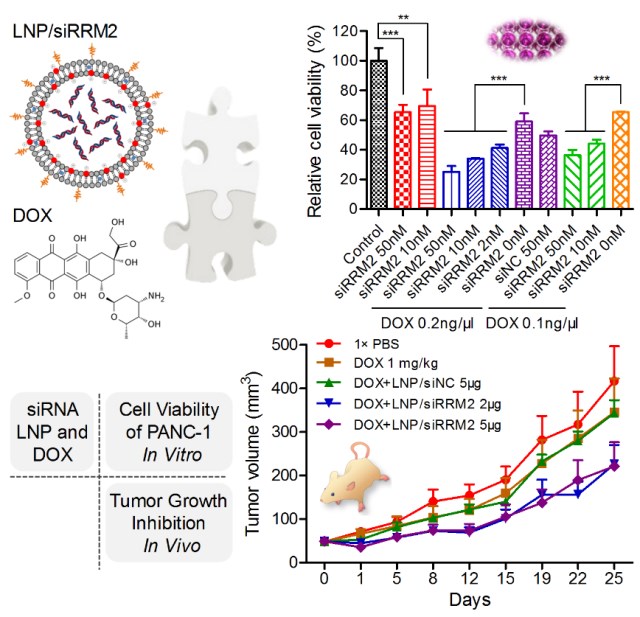
圖1 siRRM2或siRRM2/DOX聯(lián)和給藥在體內(nèi)外抑制胰腺癌細(xì)胞活力和腫瘤生長(zhǎng)的效果
該研究課題組成員翁郁華博士,以及北京大學(xué)合作者鄭書全、王曉霞為并列第一作者,黃淵余為通訊作者,北理工為第一單位。課題得到北理工創(chuàng)新人才計(jì)劃優(yōu)青培育專項(xiàng)資助。
2.小干擾核酸藥物研究進(jìn)展的綜述——ESI高被引論文
基于獲得諾貝爾獎(jiǎng)的RNAi機(jī)制的小干擾核酸(siRNA)藥物是通過攻擊細(xì)胞內(nèi)基因的信使RNA達(dá)到治療疾病目的的一類全新的藥物分子。小分子化合物與抗體蛋白類藥物作用時(shí),通常是依賴于空間立體結(jié)構(gòu)上的特異性親和,實(shí)現(xiàn)對(duì)靶蛋白的功能阻斷。RNAi療法則指向了“中心法則”的“中間環(huán)節(jié)”——信使RNA,基于堿基互補(bǔ)配對(duì)原攻擊靶基因信使RNA,阻斷其蛋白表達(dá)。當(dāng)今生物醫(yī)學(xué)已發(fā)展到后基因組時(shí)代,遵從序列特征發(fā)揮作用的小干擾核酸藥物可根據(jù)人類基因組信息直接設(shè)計(jì)獲得,是一種“信息”藥物,作為一類全新的前沿制藥技術(shù)平臺(tái),必將對(duì)未來藥物的開發(fā)模式和疾病的治療管理模式形成革命性的影響。美國(guó)東部時(shí)間8月10日,F(xiàn)DA批準(zhǔn)了全球第一款RNAi藥物Onpattro,作為本領(lǐng)域里程碑式重大進(jìn)展,預(yù)示著RNAi制藥將步入快軌道,迎來蓬勃發(fā)展期。
2017年3月,黃淵余針對(duì)本領(lǐng)域的最新研究進(jìn)展,以“Preclinical and Clinical Advances of GalNAc-Decorated Nucleic Acid Therapeutics”為題在Mol Ther Nucleic Acids上發(fā)表了重要綜述論文,系統(tǒng)探討了近年發(fā)展成熟的GalNAc(N’-乙酰半乳糖胺)綴合siRNA技術(shù)。該技術(shù)將多簇GalNAc分子通過連接子(linker)直接連接在siRNA藥物上,經(jīng)皮下注射即可高效安全的將siRNA遞送到肝實(shí)質(zhì)細(xì)胞。結(jié)合增強(qiáng)的化學(xué)修飾技術(shù),GalNAc-siRNA綴合藥物已可實(shí)現(xiàn)單次皮下給藥后藥效維持半年、甚至一年,這一超長(zhǎng)效性與其高有效性和高安全性,預(yù)計(jì)將顛覆很多慢性肝源性疾病的管理和治療模式,形成革命性的新療法,從而將給人類健康帶來巨大福祉!論文中,作者從技術(shù)內(nèi)涵、siRNA修飾策略、以及臨床前和臨床藥物研發(fā)進(jìn)展方面進(jìn)行了系統(tǒng)綜述,總結(jié)了藥物研究的重要進(jìn)展和數(shù)據(jù),并就該領(lǐng)域發(fā)展進(jìn)行了總結(jié)與展望。
時(shí)隔一年,該論文已入選Web of Science數(shù)據(jù)庫(kù)ESI高被引論文。該論文黃淵余為唯一作者,北理工為第一單位。

圖2 GalNAc綴合寡核苷酸藥物遞送機(jī)理示意圖
【作者簡(jiǎn)介】
黃淵余特別副研究員于2016年7月加入北理工前沿交叉科學(xué)研究院/生命學(xué)院,專注從事核酸技術(shù)與藥物的相關(guān)研究,主要成果包括:研究了生物/化學(xué)/物理的多類siRNA遞送載體,闡釋了結(jié)構(gòu)-活性關(guān)系,獲得的先進(jìn)脂質(zhì)體及糖綴合物載體已被用于抗乙肝等核酸藥物的臨床前研究;鑒定了兩種新型siRNA體內(nèi)分布代謝模式;揭示了siRNA降解機(jī)制,提出了增強(qiáng)修飾策略;參與了中國(guó)第一個(gè)siRNA藥物從申報(bào)到臨床的研究。至今已在Nano Letter、ACS Nano、Biomaterials、Mol Ther、Theranostics等期刊發(fā)表SCI論文34篇,累計(jì)影響因子超過245,總被引超過1200次;申請(qǐng)專利3項(xiàng)(含2項(xiàng)國(guó)際專利)。入職以來先后主持獲得北理工創(chuàng)新人才計(jì)劃優(yōu)青培育資助專項(xiàng)、國(guó)家自然科學(xué)金面上項(xiàng)目資助。
原文鏈接:
Zheng S, Wang X, Weng YH, Jin X, Ji JL, Guo L, Hu B, Liu N, Cheng Q, Zhang J, Bai H, Yang T, Xia XH, Zhang HY, Gao S, Huang Y*. siRNA Knockdown of RRM2 Effectively Suppressed Pancreatic Tumor Growth Alone or Synergistically with Doxorubicin. http://doi.org/10.1016/j.omtn.2018.08.003;
Huang Y*. Preclinical and Clinical Advances of GalNAc-Decorated Nucleic Acid Therapeutics. Mol Ther Nucleic Acids. 2017;6:116-132. doi: 10.1016/j.omtn.2016.12.003. http://doi.org/10.1016/j.omtn.2016.12.003
分享到:
