北理工在原核生物基因組編輯技術(shù)的優(yōu)化及應(yīng)用方面取得重要研究成果
發(fā)布日期:2019-09-12 供稿:生命學(xué)院 攝影:生命學(xué)院
編輯:秦奎偉 審核:徐偉 閱讀次數(shù):近日,北京理工大學(xué)生命學(xué)院霍毅欣課題組在原核生物CRISPR基因組編輯技術(shù)的優(yōu)化及應(yīng)用方面再次取得重要研究成果,并發(fā)表于TOP(頂級)期刊《Applied Microbiology and Biotechnology》。論文的第一作者為2019級博士生黃潮勇,通訊作者為霍毅欣教授,天工所張學(xué)禮和畢昌浩研究員、北理工馬曉焉特別副研究員參與了這項研究。該研究的部分工作在北理工—洛加大蘇州研究院聯(lián)合實(shí)驗室完成,項目獲得國家自然基金委面上項目、科技部重點(diǎn)研發(fā)項目、北京理工大學(xué)科技創(chuàng)新項目、以及蘇州工業(yè)園區(qū)的資助。該課題組不久前剛在Q1期刊《Microbial Cell Factories》上發(fā)表相關(guān)領(lǐng)域研究成果,論文的第一作者為2019屆碩士畢業(yè)生張姣,通訊作者為霍毅欣教授;植生所蔣宇研究員參與了這項研究。
CRISPR/Cas9作為新一代基因組編輯技術(shù),已經(jīng)被廣泛應(yīng)用于動物、植物以及微生物的基因組編輯。該技術(shù)利用化膿性鏈球菌來源的Cas9蛋白(SpCas9)產(chǎn)生位點(diǎn)特異性DNA雙鏈斷裂,再通過細(xì)胞的同源重組(HR)或非同源末端連接(NHEJ)機(jī)制修復(fù)雙鏈斷裂,同時在基因組上引入所需要的突變。與真核生物不同,原核生物普遍難以修復(fù)DNA雙鏈斷裂,絕大多數(shù)細(xì)菌缺乏NHEJ系統(tǒng),而只具有效率很低的HR系統(tǒng)。因此,大多數(shù)研究者選擇將CRISPR/Cas9與重組工程相結(jié)合,通過過表達(dá)噬菌體來源的λ-Red系統(tǒng)(一種效率很高的HR系統(tǒng))幫助原核生物修復(fù)DNA雙鏈斷裂,從而提高編輯效率。與NHEJ介導(dǎo)的基因組編輯相比,HR介導(dǎo)的基因組編輯需要一個供體DNA作為編輯模板,這使基因組編輯操作變得復(fù)雜。研究表明,某些原核生物具有類似真核生物的簡化版NHEJ系統(tǒng),這些NHEJ系統(tǒng)只需要兩個功能蛋白Ku和LigD。大腸桿菌一直以來被認(rèn)為缺乏NHEJ系統(tǒng),近年來,國內(nèi)有研究者將結(jié)核分枝桿菌和恥垢分枝桿菌來源的NHEJ系統(tǒng)導(dǎo)入大腸桿菌,成功地開發(fā)出了一種不依賴HR的基因組編輯方法用于快速刪除大腸桿菌基因組序列,大大加速了大腸桿菌遺傳改造的進(jìn)程。事實(shí)上,國外有研究者證明大腸桿菌具有一個類似于NHEJ的末端連接系統(tǒng)(研究者將其命名為A-EJ),該系統(tǒng)的功能蛋白不是Ku和LigD,而是RecBCD和LigA。由于A-EJ修復(fù)DNA雙鏈斷裂的效率遠(yuǎn)低于NHEJ,目前還沒有利用A-EJ進(jìn)行基因組編輯的報道。是否有可能用A-EJ代替NHEJ進(jìn)行基因組編輯呢?答案是肯定的。
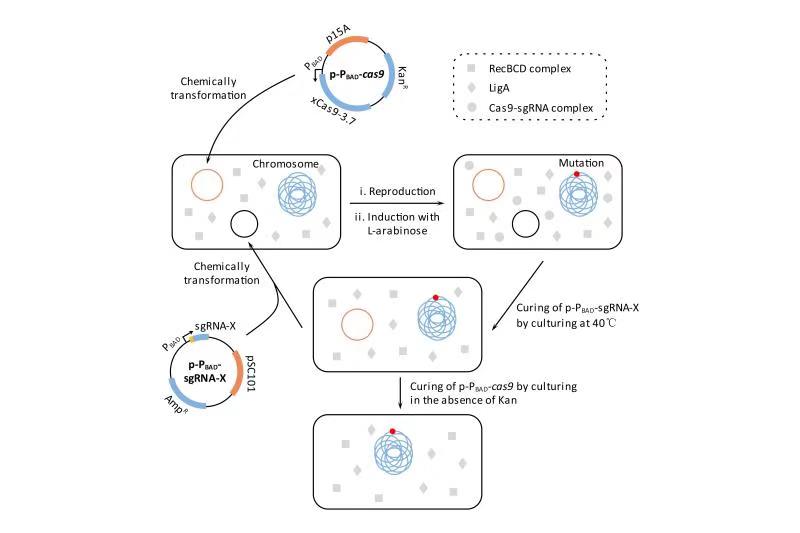
圖1 基于CNEE的基因組編輯流程
北京理工大學(xué)生命學(xué)院的霍毅欣教授課題組利用David Liu課題組開發(fā)的 xCas9-3.7(SpCas9的進(jìn)化版突變體)和Jennifer Doudna課題組改造的sgRNA(tracrRNA : crRNA的強(qiáng)化版融合體)構(gòu)建了一個雙質(zhì)粒嚴(yán)謹(jǐn)誘導(dǎo)型的基因組編輯系統(tǒng),并將其命名為CNEE。該系統(tǒng)極為簡單,其功能組件只有Cas9和sgRNA,沒有任何外源的DNA修復(fù)蛋白,利用該系統(tǒng),即使宿主的DNA修復(fù)系統(tǒng)效率極低,也能高效率地進(jìn)行基因組編輯。該課題組將CNEE系統(tǒng)導(dǎo)入大腸桿菌,在宿主A-EJ系統(tǒng)的協(xié)助下,實(shí)現(xiàn)了高效的基因敲除和長達(dá)83 kb的大片段刪除(圖1)。這種方法不需要編輯模板,可以實(shí)現(xiàn)快速迭代的大腸桿菌遺傳改造,并且編輯效率不依賴于高轉(zhuǎn)化活性的宿主細(xì)胞。由于RecBCD和LigA(或它們的同源基因)在所有的原核生物中都存在,因此理論上CNEE系統(tǒng)適用于任何原核生物的基因組編輯。隨后,該課題組在CNEE的基礎(chǔ)上構(gòu)建了一個變異系統(tǒng),為了方便描述,暫且把該系統(tǒng)稱為CNEE-V1。將CNEE-V1導(dǎo)入大腸桿菌,可以在宿主RecA同源重組系統(tǒng)的協(xié)助下實(shí)現(xiàn)高效精確的基因組編輯,包括序列的刪除、插入和替換。CNEE-V1是對CNEE的有效補(bǔ)充;由于RecA(或它的同源基因)在所有的原核生物中都存在,因此理論上CNEE-V1也適用于任何原核生物的基因組編輯。此外,該課題組還證明,將分枝桿菌來源的NHEJ系統(tǒng)引入CNEE可以進(jìn)一步增強(qiáng)CNEE的性能;同樣,將噬菌體來源的λ-Red系統(tǒng)可以進(jìn)一步增強(qiáng)CNEE-V1的性能。相關(guān)成果發(fā)表于TOP(頂級)期刊《Applied Microbiology and Biotechnology》,原文鏈接:https://doi.org/10.1007/s00253-019-10104-w

圖2 谷氨酸棒桿菌遺傳改造提高異丁酸產(chǎn)量
CRISPR/Cpf1是繼CRISPR/Cas9之后被開發(fā)出來的基因組編輯系統(tǒng)。與CRISPR/Cas9相比,CRISPR/Cpf1脫靶率更低且所需的核酸酶和RNA分子更小,因此在基因組編輯領(lǐng)域具有巨大的應(yīng)用潛力。然而,編輯效率相對較低限制了CRISPR/Cpf1基因編輯系統(tǒng)的應(yīng)用。谷氨酸棒桿菌是一種重要的工業(yè)生產(chǎn)菌株,此前,研究者利用CRISPR/Cpf1在谷氨酸棒桿菌中進(jìn)行基因組編輯的效率低于15%,且無法利用線性DNA作為修復(fù)模板。因此,該課題組針對谷氨酸棒桿菌的基因組編輯對CRISPR/Cpf1系統(tǒng)進(jìn)行了系統(tǒng)的優(yōu)化,優(yōu)化參數(shù)包括PAM序列、間隔序列的長度、修復(fù)模板的類型。利用優(yōu)化后的CRISPR/Cpf1系統(tǒng)在谷氨酸棒桿菌中進(jìn)行基因組編輯的效率顯著提高,且可以利用線性DNA作為修復(fù)模板。隨后,該課題組利用優(yōu)化后的CRISPR/Cpf1系統(tǒng)對野生型谷氨酸棒桿菌進(jìn)行遺傳改造,通過敲除基因 pyc 、 ldh 和 adhA 成功地提高了異丁酸的產(chǎn)量(圖2)。相關(guān)成果發(fā)表于《Microbial Cell Factories》,原文鏈接:https://doi.org/10.1186/s12934-019-1109-x
附霍毅欣簡介:
霍毅欣教授本科畢業(yè)于南開大學(xué),獲北京大學(xué)和巴黎七大雙博士學(xué)位,曾經(jīng)在法國巴斯德研究所、美國加州大學(xué)洛杉磯分校等歐美科研院校和生物公司學(xué)習(xí)和工作十三年,兼有在學(xué)術(shù)界從事基礎(chǔ)研究和工業(yè)界開展應(yīng)用轉(zhuǎn)化研究的經(jīng)歷。2016年起在北京理工大學(xué)組建代謝工程課題組,圍繞著“天然資源的微生物精煉與制造”,以“人工細(xì)胞工廠的設(shè)計-構(gòu)建-篩選-放大”為主線,以多種模式生物為研究對象,開展了一系列研究,取得了多項研究成果。自2018年以來以通訊作者或第一作者身份在頂級期刊Nature Communications(1篇)、Metabolic Engineering(1篇)、Applied Microbiology and Biotechnology(4篇)、Current Opinion in Biotechnology(1篇)及重要期刊ACS Synthetic Biology(1篇)、Microbial Cell Factories(2篇)、Engineering(1篇)、Journal of Biotechnology (1篇)、JoVE(1篇)上發(fā)表論文,申請多項發(fā)明專利。
分享到:
