北理工研究成果在《Nature Communications》在線發(fā)表
發(fā)布日期:2020-04-01 供稿:生命學院 攝影:生命學院
編輯:秦奎偉 審核:羅愛芹 閱讀次數(shù):
細胞死亡在哺乳動物發(fā)育、體內平衡和疾病的不同方面至關重要。不同形式的程序性細胞死亡,如細胞凋亡、細胞壞死和自噬性細胞死亡,都有獨特的調控機制。鐵死亡是近年才發(fā)現(xiàn)的一種新的程序性細胞死亡形式,在形態(tài)學、生物化學和遺傳學水平上與其他類型的程序性細胞死亡顯著不同。細胞鐵死亡已被證實與腎功能衰竭、心血管疾病 、神經退行性疾病、病毒免疫、腫瘤和糖尿病等疾病密切相關。但目前對鐵死亡的科學認識尚顯不足,特別是對鐵死亡過程在各種疾病中的作用機制以及分子機理還亟待剖析。
日前,北京理工大學生命學院楊勇飛課題組和軍事醫(yī)學研究院陳薇課題組合作在Nature Communications上發(fā)表了題為 Nedd4 ubiquitylates VDAC2/3 to suppress erastin-induced ferroptosis in melanoma 的研究論文。該研究揭示了泛素化連接酶Nedd4通過特異性識別并降解線粒體通道蛋白VDAC2/3降低黑色素瘤細胞對鐵死亡小分子誘導劑erastin敏感性的分子機制。
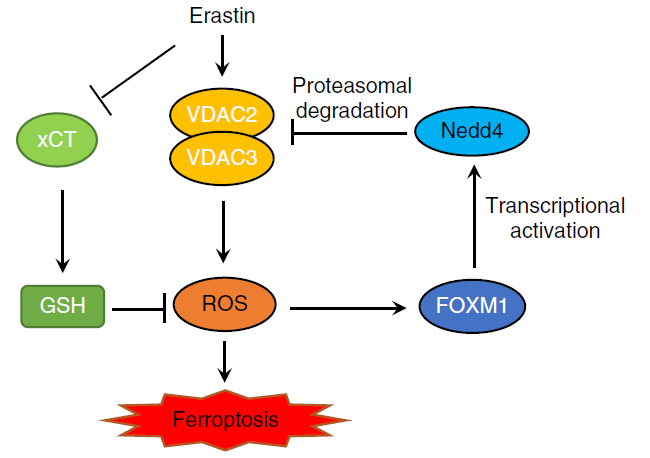
Erastin是首個被發(fā)現(xiàn)的鐵死亡小分子激活劑,在攜帶癌基因 HRAS、KRAS 和 BRAF突變的腫瘤細胞中表現(xiàn)出顯著的致死性。Erastin可以抑制細胞膜上的谷氨酸/胱氨酸反向轉運體systemXc-(xCT),減少胞內半胱氨酸含量,導致GSH合成減少和脂質ROS聚集,從而誘導鐵死亡的發(fā)生。電壓依賴性陰離子通道 (VDAC) 位于線粒體外膜上,它調控大量離子和代謝物在細胞質和線粒體之間進出,從而調節(jié)各種細胞過程,如細胞凋亡、代謝、離子穩(wěn)態(tài),從而影響許多疾病。Erastin不僅可以誘導腫瘤細胞鐵死亡,還可增強某些腫瘤細胞的化療、靶向治療和免疫治療效果。然而,erastin 處理 10 小時后,腫瘤細胞中VDAC2/3表達水平下降,并降低了腫瘤細胞對erastin的敏感性。
本研究發(fā)現(xiàn)erastin通過誘導ROS應答轉錄因子 FOXM1 激活神經元前體細胞表達發(fā)育下調 4(Nedd4)的表達。Nedd4是真核生物 HECT 結構域 E3 連接酶家族的重要成員,在進化過程中保持保守性。Nedd4 通過其WW結構域與VDAC2/3的PPxY序列結合并促進VDAC2/3降解,從而降低了癌細胞對 erastin 的敏感性。通過抑制Nedd4和FOXM1的表達,以減少VDAC2/3蛋白質降解的方法,可以增加癌細胞對erastin的敏感性。該項研究闡明了一種基于FOXM1-Nedd4-VDAC2/3負反饋回路,揭示了腫瘤細胞如何適應新的小分子藥物并維持細胞內穩(wěn)態(tài)的分子機制,并提示了以Nedd4作為靶標治療,通過細胞鐵死亡治療腫瘤的新思路。
原文鏈接:https://www.nature.com/articles/s41467-020-14324-x
Yongfei Yang, Meiying Luo, Kexin Zhang, Jun Zhang, Tongtong Gao, Douglas O’ Connell, Fengping Yao, Changwen Mu, Bingyu Cai, Yuxue Shang & Wei Chen. Nedd4 ubiquitylates VDAC2/3 to suppress erastin-induced ferroptosis in melanoma. Nature Communications, 11, 433 (2020).
DOI: https://doi.org/10.1038/s41467-020-14324-x
附作者簡介:
羅美英,北京理工大學生命學院2017級博士生, 在Nature Communications、Cell Death Differ、Cell Signal等SCI期刊發(fā)表文章5篇,其中第一作者文章3篇。
張珂欣,北京理工大學生命學院2017級碩博生,在Nature Communications、Cell Death Differ、Cell Signal等SCI期刊發(fā)表文章5篇。
分享到:
