北理工課題組在微流控芯片高內涵分子篩選實現(xiàn)多肽定向進化方面取得進展
發(fā)布日期:2022-10-24 供稿:化學與化工學院
編輯:段凱龍 審核:王振華 閱讀次數(shù):
發(fā)展性能優(yōu)良的高特異、高內涵靶向分子是實現(xiàn)活體化學測量的基礎,也是現(xiàn)代分析化學領域的前沿。與其它類型的識別分子相比,具有內源活性的靶向多肽具有更高的信息量和更好的生物相容性。因此,靶向多肽在體內分子精準靶向方面具備獨特優(yōu)勢,是有力的活體測量識別工具。然而,目前對于靶向多肽的獲取方法有限,常規(guī)分子篩選和分子進化手段難以在篩選效率、篩選精度、多肽性能構象等方面獲得突破。因此,亟待靶向多肽篩選新策略。
基于上述問題,北京理工大學王蔚芝課題組近日與新加坡國立大學陳小元課題組合作,開發(fā)了基于微流控芯片的靶向多肽分子多維度進化新方法。該方法可同時針對多個腫瘤相關靶標分子篩選兼具高親和力、高特異性和高度穩(wěn)定組裝性能的靶向多肽,在腫瘤診療中顯示出極大的優(yōu)勢。此外,該方法由于在腫瘤組織原位環(huán)境下進行分子定向進化,所獲得的分子在復雜的活體環(huán)境中更具穩(wěn)定性。成果以“Totipotent ‘All-in-one’ Peptide Sequentially Blocks Immune Checkpoint and Reverses Immunosuppressive Tumor Microenvironment”為題發(fā)表在國際頂級期刊《Advanced Materials》(IF: 32.086)上。北京理工大學為第一通訊單位,化學與化工學院博士研究生張黎民為論文第一作者,北京理工大學王蔚芝研究員為最后通訊作者。新加坡國立大學陳小元教授,國家納米科學中心胡志遠研究員,趙敏芝研究員以及北京理工大學的蔣振奇博士為共同通訊作者。
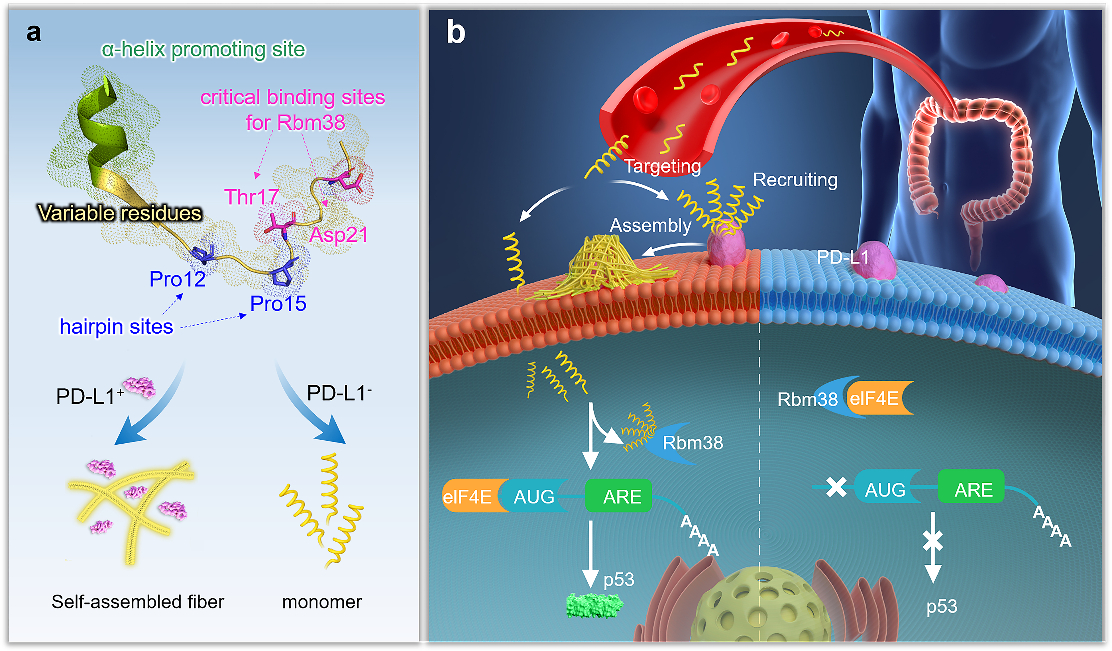
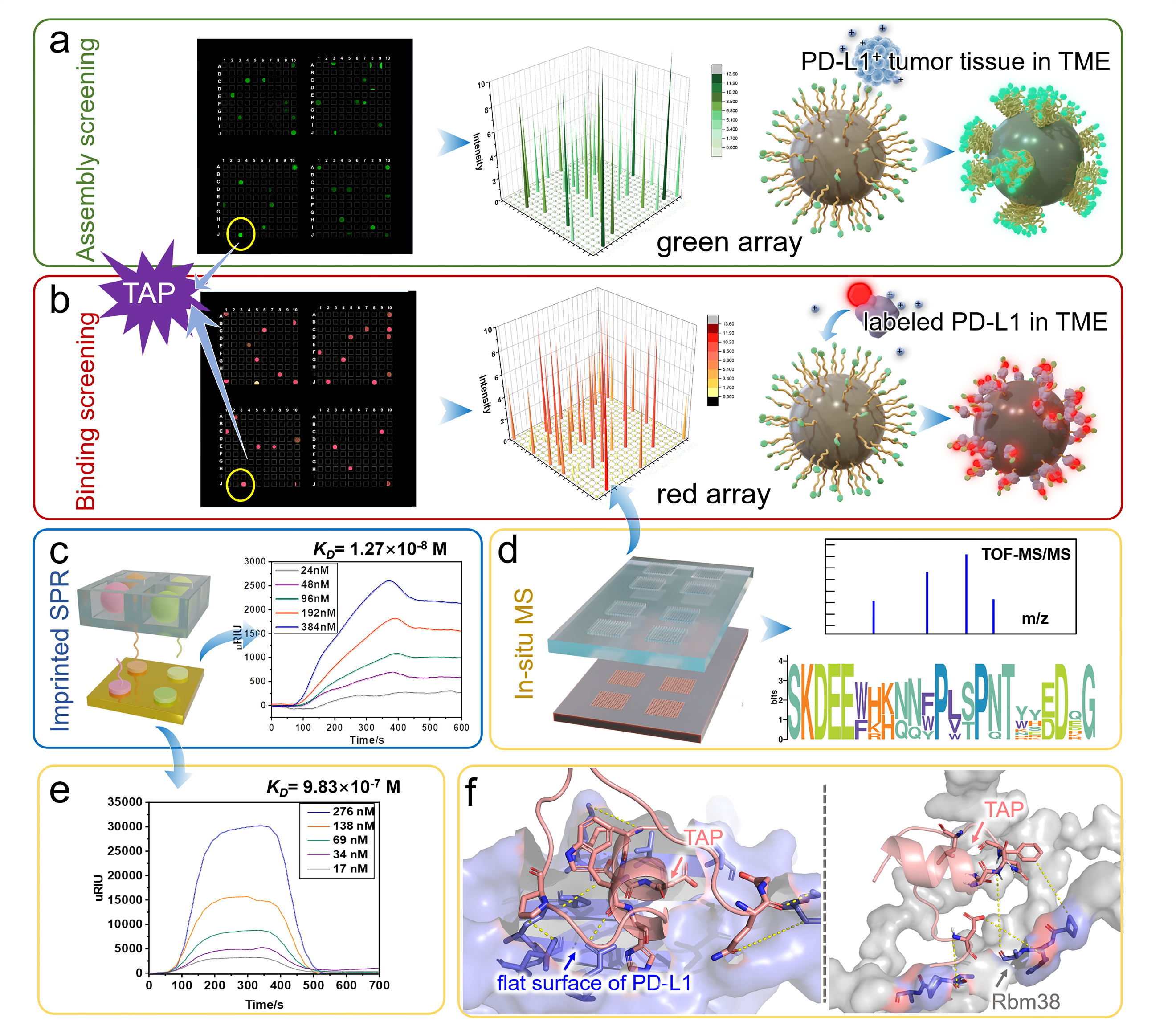
首先,通過分析靶標蛋白PD-L1與Rbm38的晶體結構,從頭設計并構筑了容量為105的多肽庫,并在肽庫中引入具有聚集誘導發(fā)光(AIE)性能的TPE分子來指示多肽的穩(wěn)定組裝性能。然后利用微陣列芯片上的三維進化策略在結合能力,自組裝性能以及特異性三個維度進行了肽庫篩選,優(yōu)化出了一條具有高內涵性能的靶向多肽TAP。
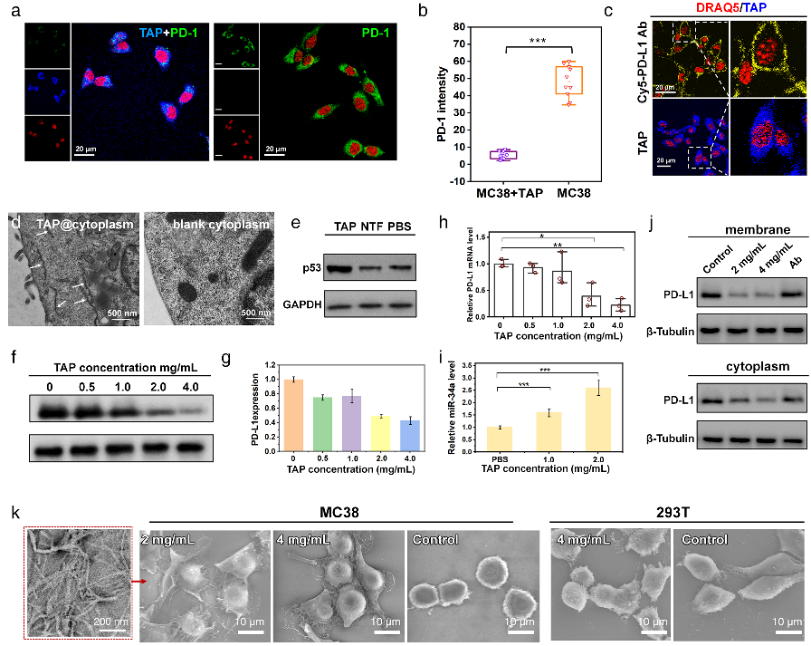
進一步地,對TAP的生物學性能進行了研究,在分子及細胞水平上證明了TAP不僅能阻斷Rbm38-eIF4E復合物的形成上調p53表達,也能阻斷PD-1/PD-L1相互作用。值得注意的是,TAP具有全面下調細胞內外PD-L1含量的能力,這進一步增加了其活體診療效果。同時,由于TAP的組裝性能使其在PD-L1的招募下快速形成穩(wěn)定的納米纖維進一步促進了其對相關通路的穩(wěn)定持續(xù)調控。總而言之,TAP在細胞膜上自組裝阻斷PD-L1,同時下調整個細胞中PD-L1的表達,這與其激活p53的能力相結合,使TAP成為一種潛在的強大的抗腫瘤先導分子。
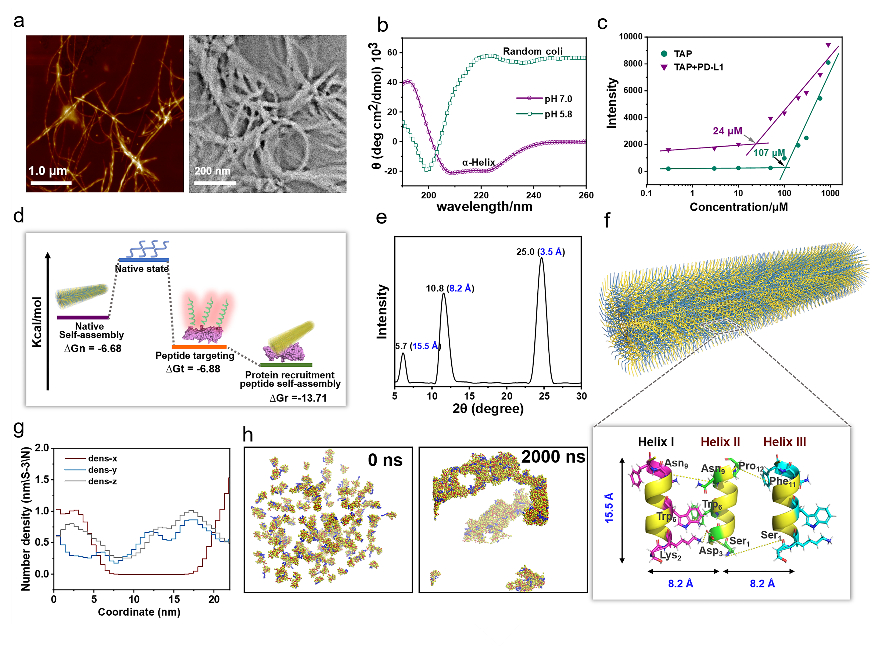
進一步的,通過使用AFM、TEM、CD、XRD及分子動力學模擬等手段對TAP自組裝行為進行了研究。證明了其可在腫瘤微環(huán)境中能夠轉變成α-helix結構,并通過對PD-L1的特異性識別和招募下以極低的濃度進行快速組裝。
在正常小鼠及免疫抑制小鼠水平上,證實了TAP能特異性的靶向腫瘤組織,并展示出優(yōu)于抗體的抗腫瘤效果。
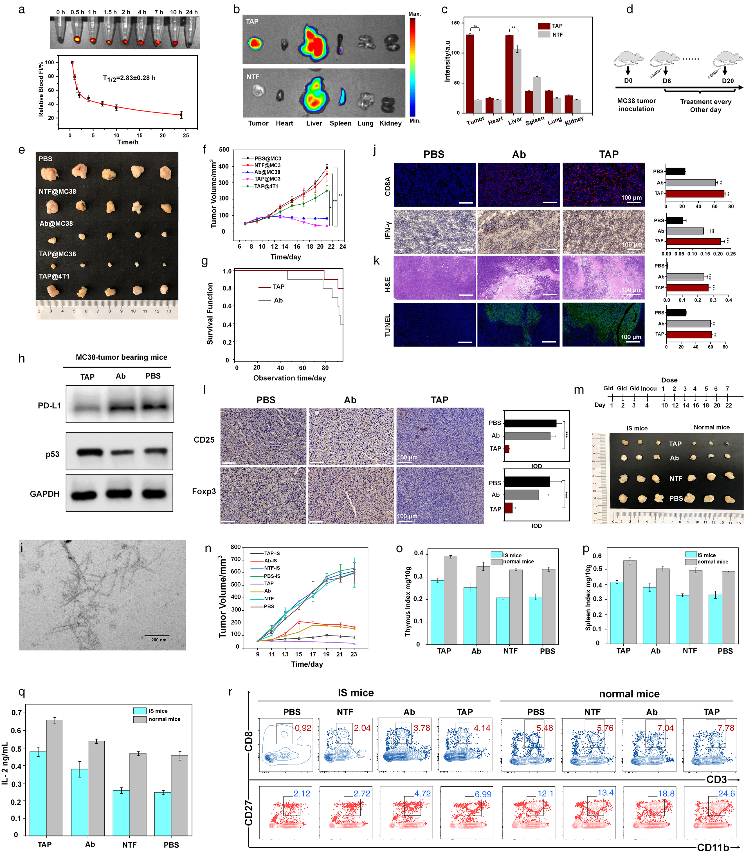
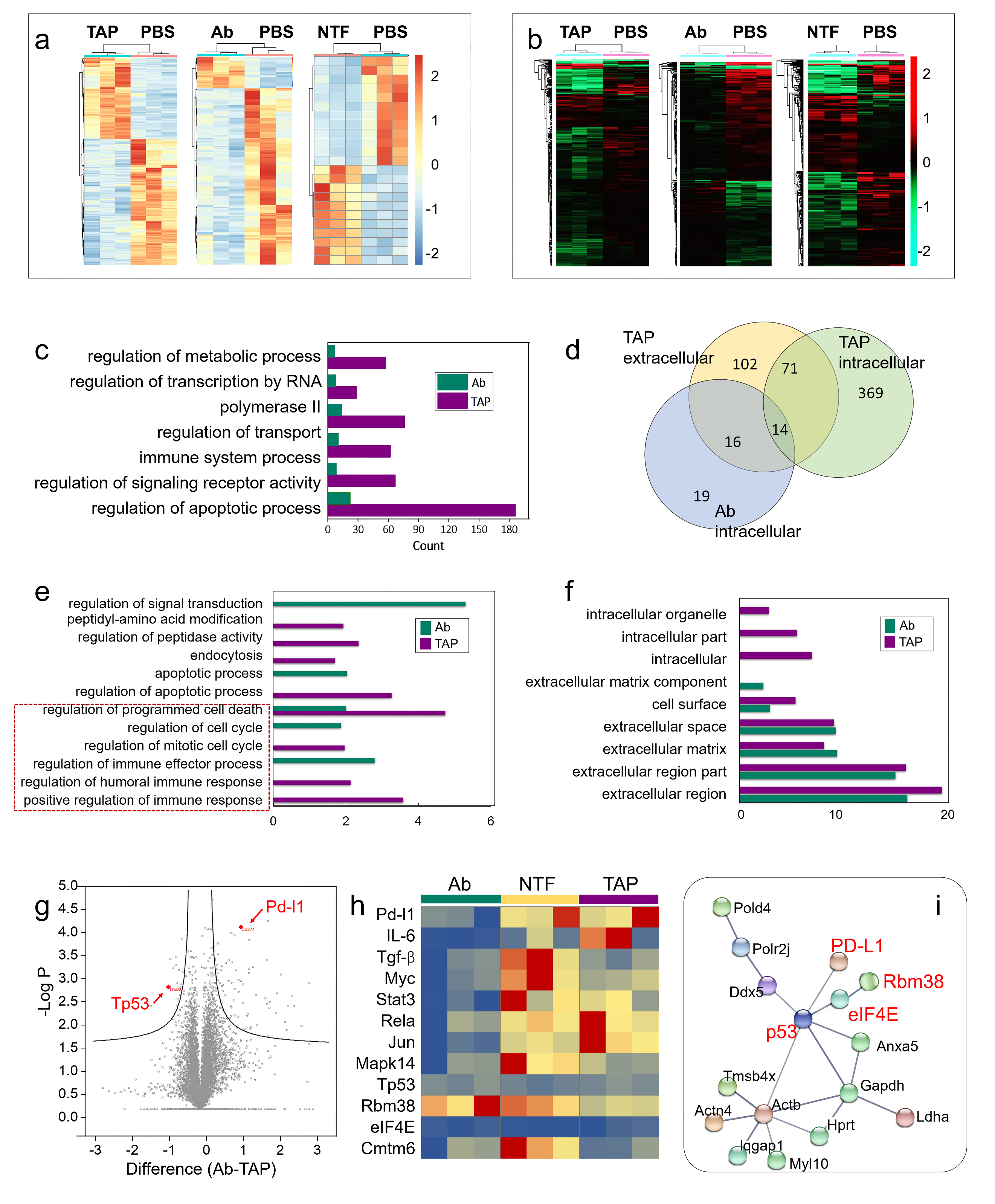
為了進一步了解TAP抑癌分子機制,采用了基于RNA測序(RNA-seq)的轉錄組和基于質譜的蛋白質組方法繪制了遺傳和蛋白質組圖譜。
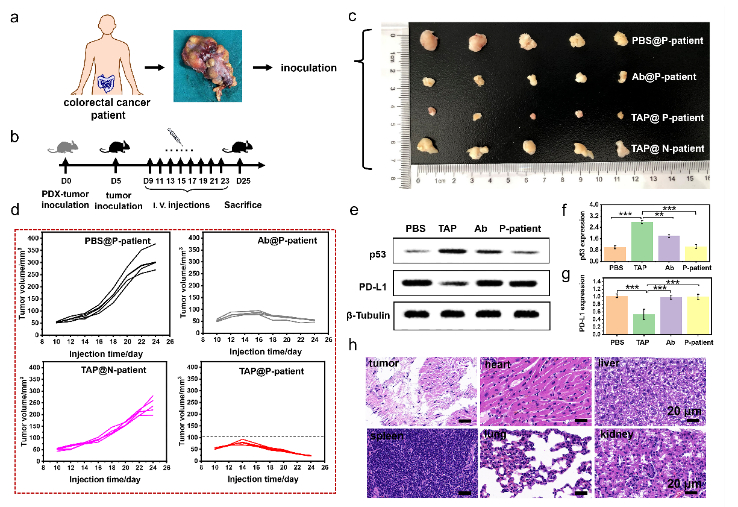
最后,在患者來源腫瘤異種移植(PDX)模型中,對TAP的抗腫瘤效果進行了驗證。
總的來說,該研究通過基于微流控芯片的靶向多肽多維度進化方法成功篩選出了具有多重性能的新型靶向多肽分子。并在分子、細胞、活體、PDX水平上對其抗腫瘤效果及機制進行了詳細的研究。該工作為高內涵靶向多肽的篩選提供了新方法,也為基于分子識別的癌癥精準診療提供了新思路。
山西省中醫(yī)院,上海交通大學附屬瑞金醫(yī)院,上海中醫(yī)藥大學附屬龍華醫(yī)院等在患者組織樣本及醫(yī)學倫理評估等方面給予了大力支持。
分享到:
