北理工在可離子化脂質(zhì)體實(shí)現(xiàn)mRNA治療方面取得進(jìn)展
發(fā)布日期:2020-12-29 供稿:前沿交叉科學(xué)研究院
編輯:朱倩云 審核:唐水源 閱讀次數(shù):近日,北京理工大學(xué)前沿交叉科學(xué)研究院黃淵余課題組在mRNA遞送及其在肝組織高效表達(dá)方面取得重要研究進(jìn)展。該研究成果以《Efficient hepatic delivery and protein expression enabled by optimized mRNA and ionizable lipid nanoparticle》發(fā)表于生物醫(yī)學(xué)領(lǐng)域頂級(jí)期刊《Bioactive Materials》(中國(guó)卓越期刊高起點(diǎn)期刊,IF2019=8.724,即時(shí)IF>12)。該論文第一作者為北京理工大學(xué)生命學(xué)院/前沿交叉院博士研究生楊同仁、李春輝及北京大學(xué)王曉霞博士,通訊作者為北京理工大學(xué)黃淵余研究員和翁郁華副研究員。
理論上,信使RNA(mRNA)具有表達(dá)任何蛋白質(zhì)的能力,因此mRNA療法在疫苗研發(fā)、蛋白質(zhì)替代治療、表達(dá)抗體治療、腫瘤免疫治療及改造CAT-T細(xì)胞等細(xì)胞療法等方向均有廣闊的應(yīng)用前景。目前新冠肺炎的疫苗研發(fā)中,美國(guó)Moderna、德國(guó)BioNTech等生物技術(shù)企業(yè)開發(fā)的mRNA疫苗均已獲得緊急使用授權(quán),國(guó)內(nèi)也有一些企業(yè)正基于mRNA平臺(tái)開發(fā)新冠肺炎疫苗。
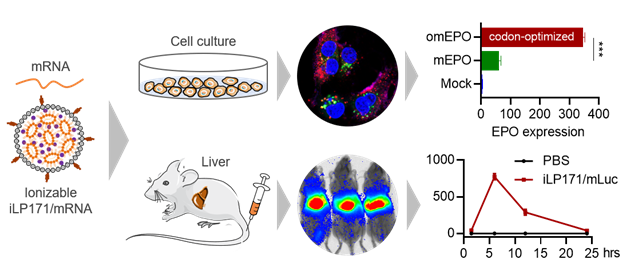
圖1 研究示意圖
與質(zhì)粒DNA相比,mRNA具有入胞后不需要進(jìn)入細(xì)胞核、快速表達(dá)蛋白、不會(huì)整合到宿主基因組等優(yōu)勢(shì);與傳統(tǒng)蛋白分子相比,mRNA具有生產(chǎn)成本低、可塑性強(qiáng)、設(shè)計(jì)篩選迅速便捷等優(yōu)點(diǎn)。但由于其分子量大(300-5000 kDa,1-15 kb)、帶負(fù)電荷、易降解,天然的mRNA較難進(jìn)入細(xì)胞發(fā)揮作用。因此,迫切需要提高mRNA的穩(wěn)定性、提高mRNA表達(dá)效率、開發(fā)合適的mRNA遞送系統(tǒng)。在mRNA制藥領(lǐng)域,mRNA的化學(xué)修飾和密碼子優(yōu)化是提高mRNA穩(wěn)定性的關(guān)鍵技術(shù)。在遞送方面,可電離脂質(zhì)納米顆粒(iLNP)是最具應(yīng)用前景的核酸遞送載體。已獲批上市的全球第一種siRNA藥物Onpattro?和上述Moderna、BioNTech開發(fā)的新冠肺炎mRNA疫苗都是脂質(zhì)體制劑。在這項(xiàng)研究中,研究人員探究了一種可離子化的脂質(zhì)納米體系iLP171,并對(duì)iLP171遞送mRNA的效率和蛋白質(zhì)表達(dá)情況進(jìn)行了體外和體內(nèi)研究(圖1)。
已有研究證明,遞送載體系統(tǒng)的pKa值處于6.0至6.5時(shí),通常可響應(yīng)內(nèi)涵體pH值改變迅速離子化,從而與內(nèi)涵體膜成分中的磷脂成分發(fā)生相互作用,破壞內(nèi)涵體膜穩(wěn)定性,促使核酸分子從內(nèi)涵體中逃逸到細(xì)胞質(zhì),同時(shí)釋放核酸分子。該研究證明iLP171體系的pKa值為6.28,完全符合可離子化脂質(zhì)體的要求。為了使mRNA具有最佳的蛋白質(zhì)翻譯效率,研究人員還對(duì)表達(dá)促紅細(xì)胞生長(zhǎng)素(Erythropoietin, EPO)的mRNA進(jìn)行了密碼子優(yōu)化,并在體外轉(zhuǎn)錄時(shí)進(jìn)行抗反向帽類似物(ARCA)加帽和poly(A)加尾。數(shù)據(jù)證明,密碼子優(yōu)化的EPO mRNA的蛋白表達(dá)效率顯著高于未進(jìn)行密碼子優(yōu)化的EPO mRNA(圖1)。
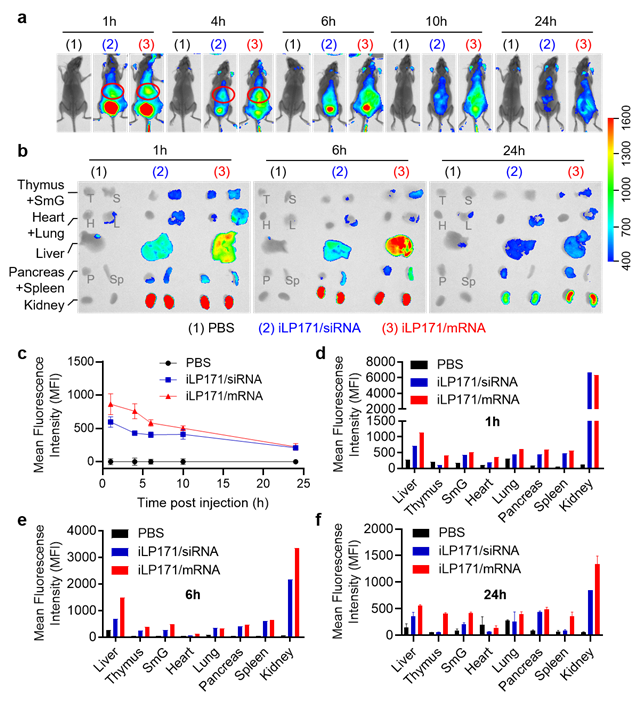
圖2 iLP171/mRNA在小鼠體內(nèi)的分布
進(jìn)一步,研究人員將iLP171/mRNA制劑經(jīng)尾靜脈注射到小鼠體內(nèi)評(píng)估其體內(nèi)效果。數(shù)據(jù)顯示,iLP171/mRNA主要積聚在肝臟(如紅圈所示)和腎臟(圖2a和2b),對(duì)全身(圖 2c)和分離臟器(圖2d-f)的熒光定量分析進(jìn)一步證實(shí)了這些結(jié)果。有研究表明,可離子化的核酸脂質(zhì)體進(jìn)入血液循環(huán)系統(tǒng)后,可能與載脂蛋白E(ApoE)結(jié)合,從而識(shí)別肝實(shí)質(zhì)細(xì)胞表達(dá)的低密度脂蛋白受體(LDLR),實(shí)現(xiàn)主動(dòng)肝靶向遞送過程。腎臟的富集則因?yàn)楹怂嶂|(zhì)體主要通過腎臟清除。
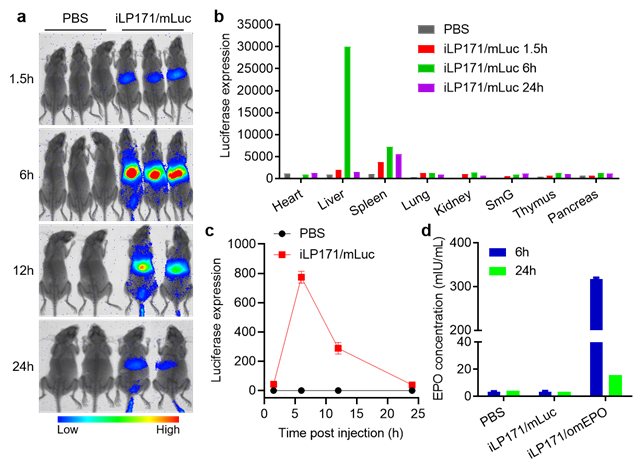
圖3 iLP171/ mRNA在小鼠體內(nèi)蛋白表達(dá)情況
研究人員進(jìn)一步考察了iLP171/mLuc(表達(dá)熒光素酶的mRNA)在小鼠體內(nèi)的蛋白表達(dá)情況。結(jié)果表明,熒光素酶主要在肝臟中穩(wěn)定表達(dá),且在給藥后6 h達(dá)到峰值;在脾臟有少量表達(dá),在其他器官中幾乎不表達(dá)(圖3a-c)。這些結(jié)果與iLP171/mRNA體內(nèi)分布結(jié)果一致。同樣地,iLP171/mEPO也在給藥后6 h在血液中達(dá)到最高濃度,這表明mRNA的遞送、蛋白翻譯以及蛋白質(zhì)的分泌過程均非常高效和迅速(圖3d)。同時(shí),該論文還研究了該脂質(zhì)體核酸體系的體內(nèi)安全性,病理切片、血清生化等指標(biāo)均表明該體系擁有良好的體內(nèi)安全性。
綜上所述,此項(xiàng)研究證明了iLP171可高效地將密碼子優(yōu)化的mRNA遞送至肝實(shí)質(zhì)細(xì)胞,高效表達(dá)目的蛋白,并擁有良好的安全性。該研究為貧血疾病的治療以及mRNA藥物或疫苗的開發(fā)奠定了基礎(chǔ)。
附作者簡(jiǎn)介:
黃淵余,北京理工大學(xué)研究員、課題組長(zhǎng)、博士生導(dǎo)師。研究興趣主要圍繞核酸技術(shù)與藥物展開,包括核酸藥物(如siRNA、mRNA等)的設(shè)計(jì)篩選、藥物遞送以及重大疾病的創(chuàng)新診治技術(shù)研究。目前在Nano Today、Adv Funct Mater、Nano Lett、Biotechnol Adv等期刊發(fā)表SCI論文50余篇;其中第一或通訊作者論文30余篇,含IF>10論文13篇、ESI高被引論文3篇。著述專著6章、中文教材1部;申請(qǐng)專利6件,含授權(quán)PCT專利2件。先后主持國(guó)家自然科學(xué)基金等項(xiàng)目10余項(xiàng)。入選北京市科技新星(2020)、北京市科協(xié)先進(jìn)工作者(2020)、北京市科協(xié)青年托舉人才(2019),獲得中美納米醫(yī)學(xué)與納米生物技術(shù)學(xué)會(huì)“未來之星”獎(jiǎng)(2019)、教育部學(xué)術(shù)新人等榮譽(yù)。是中國(guó)生物物理學(xué)會(huì)納米生物學(xué)分會(huì)秘書長(zhǎng)、理事,另4個(gè)學(xué)會(huì)理事或委員;是Advances(Wiley合作新刊)副主編、Chinese Chemical Letters等多個(gè)期刊編委。
翁郁華,北京理工大學(xué)副研究員,碩士生導(dǎo)師。研究方向?yàn)楹怂崴幬镞f送技術(shù)和診療一體化納米藥物。設(shè)計(jì)、測(cè)試與開發(fā)了多種類型的核酸藥物載體和納米藥物,并產(chǎn)生了一些有意義的發(fā)現(xiàn)。至今共發(fā)表論文20余篇,其中以第一或通訊作者在Advanced Science、Biotechnology Advances、Acta Pharmaceutica Sinica B、Molecular Therapy- Nucleic Acids 等高水平期刊發(fā)表論文10余篇,含2篇 ESI 高被引論文;申請(qǐng)專利4件,含授權(quán)專利2件;著述專著1章;先后主持承擔(dān)國(guó)家自然科學(xué)基金青年基金、博士后科學(xué)基金、省級(jí)自然基金等多個(gè)項(xiàng)目。
論文詳情:
Tongren Yang#, Chunhui Li#, Xiaoxia Wang#, Deyao Zhao, Mengjie Zhang, Huiqing Cao, Zicai Liang, Haihua Xiao, Xing-Jie Liang, Yuhua Weng?, Yuanyu Huang?. Efficient hepatic delivery and protein expression enabled by optimized mRNA and ionizable lipid nanoparticle. Bioact Mater. 2020; 5(4):1053-1061.
DOI: 10.1016/j.bioactmat.2020.07.003
教師主頁: http://arims.bit.edu.cn/xzdw/qnggjs/tbyjy/178349.htm
論文鏈接: https://www.sciencedirect.com/science/article/pii/S2452199X20301304?via%3Dihub
分享到:
