北理工在智能響應的聚合物膠束實現(xiàn)siRNA高效內涵體逃逸方面取得進展
發(fā)布日期:2021-04-06 供稿:前沿交叉科學研究院
編輯:包長青 審核:唐水源 閱讀次數:
近期,北京理工大學前沿交叉科學研究院黃淵余課題組在pH響應性聚合物膠束介導siRNA高效內涵體逃逸和腫瘤治療方面取得重要研究進展。該研究成果在頂級期刊《Nano Letters》(影響因子11.238)上在線發(fā)表,題為《Core Role of Hydrophobic Core of Polymeric Nanomicelle in Endosomal Escape of siRNA》,并被編委會選為“Supplementary Journal Cover”。北京理工大學生命學院/前沿交叉院博士研究生李春輝為第一作者,黃淵余研究員為唯一通訊作者。
小干擾核酸(siRNA)藥物近年來連續(xù)獲批上市,已成為繼小分子和抗體之后,引領第三次制藥浪潮的代表性技術之一。siRNA藥物在細胞質中發(fā)揮作用,但其自身難以進入細胞。除了研究荷載siRNA高效富集到靶組織、促發(fā)胞吞的遞送載體外(“進得去”),如何顯著提高已被胞吞的siRNA從內涵體逃逸到細胞質的效率(“出得來”)是開發(fā)siRNA藥物的關鍵科學問題和重要研究方向。前期已有研究表明,內吞入胞的siRNA只有1-2% (甚至低于1%) 能從內涵體中逃逸到細胞質。
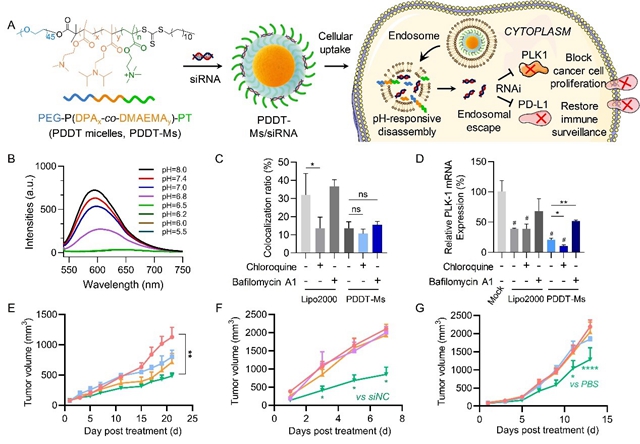
圖1 PDDT-Ms/siRNA示意圖及體內外效應研究
由于其易于合成和修飾、組成簡單、可實現(xiàn)親水-疏水轉換等優(yōu)點,高分子聚合物載體受到研究者的廣泛關注。在本項研究中,黃淵余課題組設計合成了一種新型pH響應性的三嵌段聚合物mPEG45-P(DPA50- co -DMAEMA56)-PT53(PDDT),可高效負載siRNA并實現(xiàn)快速的內涵體逃逸,并通過遞送與癌細胞增殖相關的PLK1 siRNA或腫瘤免疫檢查點相關的PD-L1 siRNA,實現(xiàn)了有效的腫瘤治療(圖1A)。
研究者首先考察了PDDT-Ms納米膠束的pH響應性,結果顯示其在中性生理條件下較為穩(wěn)定,在微酸性環(huán)境(類似內涵體的pH環(huán)境)下快速崩解(圖1B),該特點適用于siRNA藥物的體內智能遞送。細胞水平的機制研究顯示,PDDT-Ms/siRNA轉染細胞后,相較于商業(yè)化的轉染試劑Lipofectamine 2000(Lipo2000),PDDT-Ms/siRNA與內涵體、溶酶體共定位的比例更低,意味著PDDT-Ms/siRNA擁有更強的逃逸能力(圖1C)。研究者進一步利用內涵體/溶酶體破壞劑氯喹(Chloroquine)、抑制內涵體/溶酶體酸化的小分子巴佛洛霉素A1(Bafilomycin A1)探究它們對Lipo2000和PDDT-Ms轉染的影響。數據顯示,與預期一致,氯喹提高了Lipo2000的內涵體逃逸效果,巴佛洛霉素A1則降低了Lipo2000的逃逸效果;這兩種小分子對PDDT-Ms的影響趨勢與Lipo2000一致,但影響程度顯著低于Lipo2000,這說明PDDT-Ms體系自身已擁有足夠強的逃逸能力(圖1C)。相應的細胞水平的基因表達抑制效率呈現(xiàn)出與內涵體逃逸一致的趨勢(圖1D)。進一步,研究人員在小鼠上分別建立了肝癌細胞系異種移植的CDX模型(圖1E)、肝癌患者癌組織異種移植的PDX腫瘤模型(圖1F)和結腸癌模型(圖1G)。數據顯示,在這三種腫瘤模型中,PDDT-Ms/siRNA藥物體系均可有效抑制腫瘤生長,促進癌細胞凋亡,并延長動物生存周期。同時,該論文還研究了該聚合物核酸體系的體內安全性,病理切片、血清生化等指標均表明該體系擁有良好的體內安全性。
綜上所述,這項工作中研究者設計的聚合物納米膠束PDDT-Ms能快速響應內涵體酸性pH,促進siRNA的高效內涵體逃逸與釋放從而實現(xiàn)體內外高效的基因沉默。該工作突出了內涵體逃逸在siRNA體內外治療中的重要決定性作用,為siRNA遞送載體的合理設計提供了指導,也為siRNA介導的腫瘤治療建立了良好的平臺。該工作被接收后,進一步被編委會選為“Supplementary Journal Cover”(圖2)。
作者簡介:
黃淵余,北京理工大學研究員、課題組長、博士生導師。研究興趣主要圍繞核酸技術與藥物/疫苗展開,包括核酸分子(如siRNA、mRNA等)的設計篩選、藥物遞送以及重大疾病的創(chuàng)新診治技術研究。以通訊/第一作者在Nano Today、Adv Funct Mater、Nano Lett、Biomaterials等發(fā)表論文40篇,IF>10論文14篇;共發(fā)表論文60余篇,撰寫8部專著章節(jié),申請7件專利,PCT專利多國授權。先后主持國家自然科學基金等項目10余項,入選北京市科技新星(2020),獲得中美納米醫(yī)學與納米生物技術學會“未來之星”獎(2019)等榮譽。是中國生物物理學會納米生物學分會秘書長、理事,另4個學會理事或委員;是Exploration期刊副主編、Chinese Chemical Letters等多個期刊編委。
論文詳情:Chunhui Li, Junhui Zhou, Yidi Wu, Yanliang Dong, Lili Du, Tongren Yang, Yongheng Wang, Shuai Guo, Mengjie Zhang, Abid Hussain, Haihua Xiao, Yuhua Weng, Yong Huang, Xiaoxia Wang, Zicai Liang, Huiqing Cao, Yongxiang Zhao, Xing-Jie Liang, Anjie Dong, and Yuanyu Huang?. Core Role of Hydrophobic Core of Polymeric Nanomicelle in Endosomal Escape of siRNA. Nano Lett. 2021, xx(x), xxxx-xxxx.
DOI: 10.1021/acs.nanolett.0c04468.
教師主頁:http://arims.bit.edu.cn/xzdw/qnggjs/tbyjy/178349.htm
https://www.x-mol.com/groups/Yuanyu_Huang-BIT
論文鏈接:https://pubs.acs.org/doi/full/10.1021/acs.nanolett.0c04468
分享到:
