北理工課題組揭示溶酶體自噬與生物發(fā)生的分子機制
發(fā)布日期:2023-11-17 供稿:生命學院 攝影:生命學院
編輯:肖雯 審核:周連景 閱讀次數(shù):
近日,北京理工大學生命學院董磊教授研究團隊在國際自噬領域頂級期刊《Autophagy》上發(fā)表成果“SMURF1 controls PPP3/calcineurin complex and TFEB at a regulatory node for lysosomal biogenesis”,揭示了SMURF1通過調(diào)控TFEB核轉位激活促進腫瘤細胞溶酶體再平衡的新機制。
真核生物含有一種高度保守的信號通路會在三磷酸腺苷(ATP)水平降低(如在營養(yǎng)短缺或線粒體功能障礙)的情況下迅速激活。大多數(shù)癌癥細胞會利用或重編程這種保守的通路來促進蛋白質再平衡穩(wěn)態(tài)網(wǎng)絡來維持其高增長的生長模式。我們研究發(fā)現(xiàn)SMURF1在溶酶體損傷后在平衡的過程中發(fā)揮必不可少的作用。
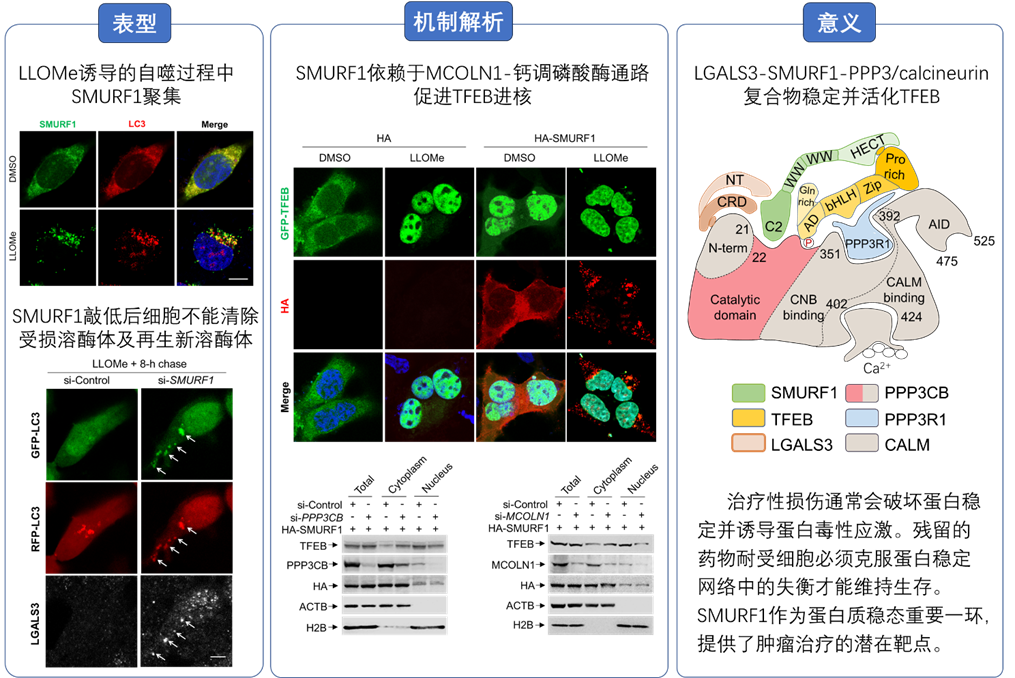
圖1 SMURF1在溶酶體損傷中的重要作用
細胞通過一系列的機制將胞質中的廢棄物質包被進囊泡中,與溶酶體融合實現(xiàn)降解、回收、再利用維持細胞質量控制穩(wěn)態(tài)。自噬降解是其過程中眾所周知非常重要的一環(huán),參與如生理和病理炎癥,衰老,感染,免疫及癌癥發(fā)展等過程。自噬-溶酶體穩(wěn)態(tài)再平衡受到核心轉錄因子EB(TFEB)的正向反饋機制受。mTOR磷酸化TFEB S211從而抑制其進核,同時,鈣調(diào)磷酸酶(PPP3/calcineurin)可以去磷酸化TFEB激活其進核啟動一系列與溶酶體生成、自噬相關基因轉錄。然而在溶酶體損傷情況下,致癌蛋白SMURF1在TFEB激活調(diào)控的過程中是否參與及其機制尚不明確。董磊教授團隊長期致力于自噬蛋白質穩(wěn)態(tài)和癌癥治療,基于此前課題組的工作結果以及現(xiàn)有的報道表明,SMURF1在癌癥發(fā)展(2020,Oncogene)、聚集體與病原體的清除以及恢復內(nèi)膜損傷后的細胞穩(wěn)態(tài)等方面扮演重要角色。對此董磊課題組深入研究了SMURF1在溶酶體內(nèi)膜損傷條件下的響應,發(fā)現(xiàn)SMURF1可促進TFEB進核。進一步的實驗和分析確立了一種LGALS3-SMURF1-PPP3/calcineurin復合體模型,該復合體穩(wěn)定與活化TFEB,從而促進其核易位激活(圖2)。其意義在于,治療性損傷通常會破壞蛋白穩(wěn)定并誘導蛋白毒性應激。殘留的藥物耐受細胞必須克服蛋白穩(wěn)定網(wǎng)絡中的失衡才能維持生存。認知了腫瘤治療的潛在靶點SMURF1作為蛋白質穩(wěn)態(tài)再平衡中的重要影響。
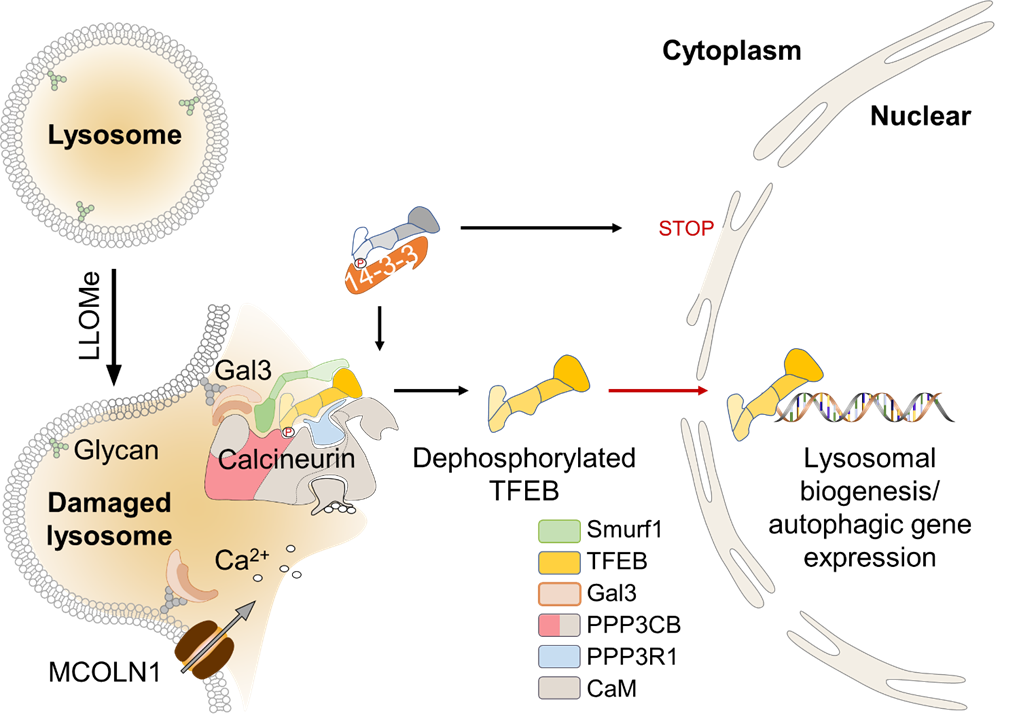
圖2 SMURF1通過調(diào)控TFEB核轉運進而促進溶酶體發(fā)生的具體過程與機制
此項研究,北京理工大學的夏琴副研究員為第一作者,北京理工大學的董磊教授為通訊作者。合作單位包括北京協(xié)和醫(yī)學院、北京生物技術研究所和北京蛋白質組學鳳凰中心。該工作得到了國家自然科學基金、北京市自然科學基金等項目的資助。
原文鏈接:https://doi.org/10.1080/15548627.2023.2267413
分享到:
